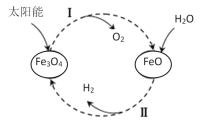
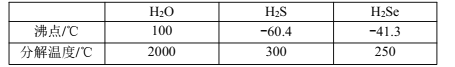
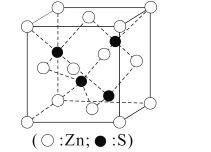
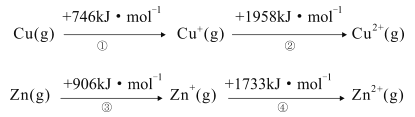题目内容
【题目】水的电离平衡曲线如图所示,根据图中数据,回答下列问题:
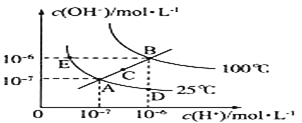
(1)图中A、B、C、D四点的Kw由大到小的顺序:________ 。
(2)若从A点到E点,可采用的方法是________。
(3)在100℃时,将pH=2的硫酸与pH=12的KOH溶液混合至呈中性,需硫酸和氢氧化钾的体积比为_____ 。
(4)pH=12的氢氧化钠溶液温度由25℃高到100℃,pH=________ 。
【答案】B>C>A=D 加入活泼金属钠、加氢氧化钠、氢氧化钡等 100:1 10
【解析】
(1)图A、E、D三点是同一曲线上,根据温度越高,离子积常数越大。
(2)若从A点到E点,温度相同,氢氧根浓度增加,氢离子浓度减小。
(3)在100℃时,先得出硫酸中c(H+)和KOH溶液中c(OH-),根据混合后呈中性得出硫酸和氢氧化钾的体积比。
(4) 25℃ pH=12的氢氧化钠溶液c(OH-),再得100℃时c(OH-),结合该温度下水的离子积计算氢离子浓度,再得pH。
(1)图A、E、D三点是同一曲线上,三点的离子积常数相等,温度是25℃,B点是100℃时的离子积常数,C温度在25℃和100℃之间,温度越高,离子积常数越大,因此A、B、C、D四点的Kw由大到小的顺序:B>C>A=D,故答案为:B>C>A=D。
(2)若从A点到E点,温度相同,氢氧根浓度增加,氢离子浓度减小,因此可采用的方法是加入活泼金属钠、加氢氧化钠、氢氧化钡等,故答案为:加入活泼金属钠、加氢氧化钠、氢氧化钡等。
(3)在100℃时,水的离子积为10-12,将pH=2的硫酸中c(H+)=0.01 molL﹣1,pH=12的KOH溶液中c(OH-)= 1 mol·L-1,两者混合至呈中性,![]() ,
,![]() ,需硫酸和氢氧化钾的体积比为100:1,故答案为:100:1。
,需硫酸和氢氧化钾的体积比为100:1,故答案为:100:1。
(4) 25℃ pH=12的氢氧化钠溶液c(OH-)=1×10﹣2 mol·L-1,100℃时c(OH-)=1×10﹣2 mol·L-1,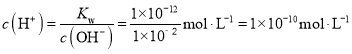 ,pH=10,故答案为:10。
,pH=10,故答案为:10。