题目内容
【题目】含氮化合物对环境、生产和人类生命活动等具有很大的影响。请按要求回答下列问题
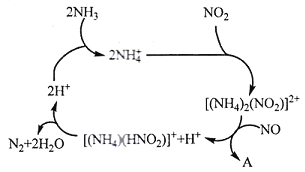
(1)利用某分子筛作催化剂,NH3可脱除工厂废气中的NO、NO2,反应机理如下图所示。A包含物质为H2O和___________(填化学式)
(2)已知:4NH3(g)+6NO(g) =5N2(g)+6H2O(g) △H1=-a kJ/mol
4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H2=-b kJ/mol
H2O(l)=H2O(g) △H3=+c kJ/mol
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l)的△H=___________ kJ/mol
(3)工业上利用氨气生产氢氰酸(HCN的反应为:CH4(g)+NH3(g)![]() HCN(g)+3H2(g ) △H>0
HCN(g)+3H2(g ) △H>0
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图甲所示。则X可以是___________(填字母序号)
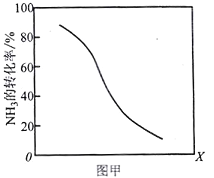
a.温度 b.压强 c.催化剂 d.![]()
②在一定温度下,向2L密闭容器中加入 n mol CH4和2 moI NH3,平衡时NH3体积分数随n变化的关系如图乙所示。
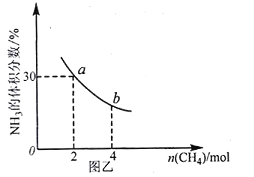
a点时,CH4的转化率为___________%;平衡常数:K(a)_____K(b)(填“>”“=”或“<”)。
(4)肌肉中的肌红蛋白(Mb)与O2结合生成MbO2,其反应原理可表示为: Mb(ag)+O2(g)![]() MbO2(aq),该反应的平衡常数可表示为:
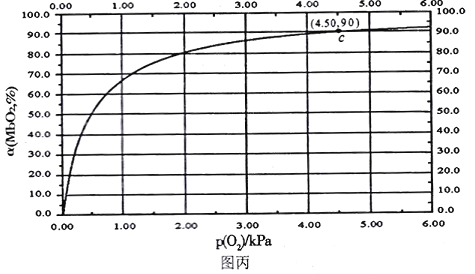
MbO2(aq),该反应的平衡常数可表示为:![]() 。在37℃条件下达到平衡时,测得肌红蛋白的结合度(a)与P(O2)的关系如图丙所示[
。在37℃条件下达到平衡时,测得肌红蛋白的结合度(a)与P(O2)的关系如图丙所示[![]() ]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。
]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。
①试写出平衡常数K与速率常数k正、k逆之间的关系式为K=___________(用含有k正、k逆的式子表示)。
②试求出图丙中c点时,上述反应的平衡常数K=___________kPa-1。已知k逆=60s-1,则速率常数k正=___________s-1·kPa-1。
【答案】N2 ![]() bd 25 =
bd 25 = ![]() 2 120
2 120
【解析】
(1)根据流程图,可知NH3与废气中的NO、NO2反应产生氮气和水;
(2)根据盖斯定律,将已知的三个热化学方程式叠加,就得到相应的反应的热化学方程式;
(3)①CH4(g)+NH3(g)![]() HCN(g)+3H2(g ) △H>0的正反应是气体体积增大的吸热反应,根据X越大,NH3的转化率越小分析影响因素;
HCN(g)+3H2(g ) △H>0的正反应是气体体积增大的吸热反应,根据X越大,NH3的转化率越小分析影响因素;
②根据加入2molNH3、2molCH4时,利用三段式法,结合平衡时氨气含量是30%,计算出各种物质的平衡物质的量,再结合反应时二者消耗关系,可计算CH4的转化率;并根据化学平衡常数的含义计算此时反应平衡常数;
(4)①根据可逆反应达到平衡状态时,V正=V逆,结合平衡常数表达式计算K与K正、K逆的关系;
②将P(O2)=4.5kPa,肌红蛋白的结合度(a)是90%,带入平衡常数表达式可得K;将K=![]() 中的K、k逆带入可得k正。
中的K、k逆带入可得k正。
(1)根据流程图可知NH3与废气中的NO、NO2反应,最终产生无毒无害的氮气和水;
(2)①4NH3(g)+6NO(g) =5N2(g)+6H2O(g) △H1=-a kJ/mol
②4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H2=-b kJ/mol
③H2O(l)=H2O(g) △H3=+c kJ/mol
根据盖斯定律,将(①×2+②×3-③×30)×![]() ,整理可得4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H=
,整理可得4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H=![]() kJ/mol;
kJ/mol;
(3)①反应CH4(g)+NH3(g)![]() HCN(g)+3H2(g )的正反应是气体体积增大的吸热反应,根据图象可知:X越大,氨气的转化率越小。
HCN(g)+3H2(g )的正反应是气体体积增大的吸热反应,根据图象可知:X越大,氨气的转化率越小。
a.升高温度,化学平衡向吸热的正反应方向移动,使氨气的转化率增大,a错误;
b.增大压强,化学平衡向气体体积减小的逆反应方向移动,使氨气的转化率降低,b正确
c.催化剂只能改变反应速率,但不能使化学平衡发生移动,因此对氨气的转化率无影响,c错误;
d.增大![]() ,相对来说氨气增大的多,平衡正向移动,但平衡移动消耗量远远小于加入氨气的量,所以氨气的转化率降低,d正确;
,相对来说氨气增大的多,平衡正向移动,但平衡移动消耗量远远小于加入氨气的量,所以氨气的转化率降低,d正确;
故合理选项是ad;
②对于反应:CH4(g) + NH3(g)![]() HCN(g)+3H2(g ),假设反应消耗CH4物质的量为x
HCN(g)+3H2(g ),假设反应消耗CH4物质的量为x
开始(mol) 2 2 0 0
转化(mol) x x x 3x
平衡(mol) 2-x 2-x x 3x
根据图象可知在平衡时氨气的体积分数是30%,可得![]() =30%,解得x=0.5,则a点时,CH4的转化率为
=30%,解得x=0.5,则a点时,CH4的转化率为![]() =25%;
=25%;
由于温度不变,所以无论是在线上任何一点,化学反应的平衡常数都不变,因此K(a)=K(b);
(4)①可逆反应达到平衡状态时,V正=V逆,由于ν正=k正·c(Mb)· P(O2),ν逆=k逆·c(MbO2),所以k正·c(Mb)· P(O2)= k逆·c(MbO2),![]() ,而反应Mb(ag)+O2(g)
,而反应Mb(ag)+O2(g)![]() MbO2(aq)的平衡常数K=
MbO2(aq)的平衡常数K=![]() ;
;
②将C点时,P(O2)=4.5,肌红蛋白的结合度(a)是90%带入平衡常数表达式中可得K=![]() =2;
=2;
K=![]() ,由于K=2,k逆=60s-1带入该式子,可得k正=Kk逆=2×60s-1=120s-1。
,由于K=2,k逆=60s-1带入该式子,可得k正=Kk逆=2×60s-1=120s-1。

【题目】经测定乙醇的分子式是C2H6O,由于有机化合物普遍存在同分异构现象,推测乙醇分子的结构可能是下列两种之一:
Ⅰ.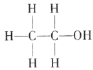 Ⅱ.
Ⅱ.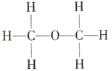
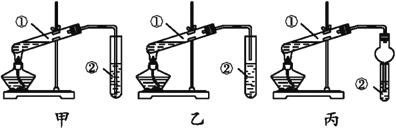
为确定其结构,应利用物质的特殊性质进行定性、定量实验。现给出乙醇、钠、水及必要的仪器,甲、乙、丙三名学生利用如图所示装置进行实验确定乙醇分子的结构。图中量气装置由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水。甲管有刻度(0~200mL),供量气用;乙管可上下移动,以调节液面高低。
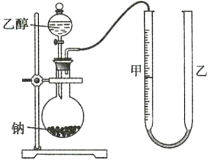
(1)学生甲得到一组实验数据;
乙醇的物质的量 | 氢气的体积(标准状况下) |
0.01mol | 0.112L |
根据以上数据推断,乙醇的结构应为___(填“Ⅰ”或“Ⅱ”),原因是___。
(2)学生乙认为:为了较准确地测量氢气的体积,除了必须检查整个装置的气密性外,在读取反应前后甲管中液面读数的过程中,应注意___(填序号)。
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时,立刻读数
c.读数时应上下移动乙管,使甲、乙两管液面相平
d.读数时不一定使甲、乙两管液面相平
(3)学生丙不想通过称取乙醇的质量来确定乙醇的物质的量,那么他还需要知道的数据是___。