题目内容
17.若用乙烯和氯气在适当的条件下反应制取四氯乙烷,这一过程中所要经历的反应及耗用氯气的量是(设乙烯为1mol,反应产物中的有机物只是四氯乙烷)( )| A. | 取代,4 mol Cl2 | B. | 加成,2 mol Cl2 | ||
| C. | 加成、取代,2 mol Cl2 | D. | 加成、取代,3 mol Cl2 |
分析 乙烯和氯气发生加成反应生成二氯乙烷,1mol双键加成需要1mol的氯气,有机物中的氢原子被氯原子可以取代.
解答 解:乙烯和氯气在适当的条件下反应制取四氯乙烷的反应是先加成再取代,有机物中1mol双键加成需要1mol的氯气,有机物中1mol氢原子被氯原子可以取代消耗氯气1mol,所以用乙烯和氯气在适当的条件下反应制取四氯乙烷,共需要氯气3mol.
故选D.
点评 熟记有机反应的实质是解题的关键,可以根据所学知识进行回答,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.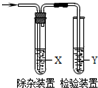 用下列方法制备乙烯并用如图所示装置检验乙烯时不需要除杂的是( )
用下列方法制备乙烯并用如图所示装置检验乙烯时不需要除杂的是( )
 用下列方法制备乙烯并用如图所示装置检验乙烯时不需要除杂的是( )
用下列方法制备乙烯并用如图所示装置检验乙烯时不需要除杂的是( )| 乙烯的制备 | 试剂X | 试剂Y | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | 水 | Br2的CCl4溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | 水 | KMnO4酸性溶液 |
| C | C2H5OH与浓H2SO4 | NaOH溶液 | KMnO4酸性溶液 |
| D | C2H5OH与浓H2SO4 | NaOH溶液 | Br2的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
8.密闭容器中,反应2X(g)?Y(g)+Z(s)已达到平衡,下列叙述正确的是( )
| A. | 若升高温度,X(g)的浓度增大,则正反应为吸热反应 | |
| B. | 若容器体积不变,在平衡混合物中加入少量Z(s),则平衡向左移动 | |
| C. | 压强变化对该平衡没有影响 | |
| D. | 若容器体积不变,加入氦气平衡不移动 |
5.下列说法正确的是( )
| A. | 聚乙烯可发生加成反应 | |
| B. | 乙烯和甲烷可用酸性高锰酸钾溶液鉴别 | |
| C. | 乙烯和苯都能与溴水反应 | |
| D. | 乙烯和乙烷都能发生加成反应 |
2.下列离子方程式书写正确的是( )
| A. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性,2MnO4-+6H++5 H2O2=2Mn2++5O2↑+8H2O | |
| B. | 硅与氢氧化钠溶液反应:Si+2OH-+H2O═SiO32-+2H2↑ | |
| C. | 次氯酸钠溶液中通入过量的SO2气体:ClO-+SO2+H2O═HClO+HSO3- | |
| D. | 足量硫化氢气体通入硫酸铁溶液中:H2S+Fe3+=Fe2++S↓+2H+ |
9.有关化学用语正确的是( )
| A. | 乙烯的实验式:C2H4 | B. | 乙炔的电子式: | ||
| C. | 甲酸甲酯的结构简式:C2H4O | D. | 氢氧根电子式: |
6.依据题目要求回答下列问题.
(1)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如下表:
①上述盐溶液中的阴离子,结合H+能力最强的是CO32-
②据上表数据,请你判断下列反应不能成立的是D(填编号)
A、CH3COOH+Na2CO3═NaHCO3+CH3COONa
B、CH3COOH+NaCN═CH4COONa+HCN
C、CO2+H2O+NaClO═NaHCO3+HClO
D、CO2+H2O+2C4H5ONa═Na2CO3+2C8H5OH
③要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为Cl2+HCO3-═CO2+Cl-+HClO.
(2)已知温下Cu(OH)2的Ksp=2×10-20,又知常温下某CuSO4溶液里c(Cu2+)=0.02mol•L-1.如果要生成Cu(OH)2,则应调整溶液pH大于5.
(3)已知可逆反应FeO(g)+CO(g)?Fe(g)+CO2(g)是炼铁工业中一个重要反应,某温度与平衡常数K的关系如下表:
①写出该反应平衡常数的表达式:K=$\frac{c(CO)}{c(C{O}_{2})}$.
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件:升高温度,混合气体的密度减小(选填“增大”“碱小”或“不变”):当$\frac{n(C{O}_{2})}{n(CO)}$=0.5,混合气体平均相对分子质量为33.3.
(1)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C4H4ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②据上表数据,请你判断下列反应不能成立的是D(填编号)
A、CH3COOH+Na2CO3═NaHCO3+CH3COONa
B、CH3COOH+NaCN═CH4COONa+HCN
C、CO2+H2O+NaClO═NaHCO3+HClO
D、CO2+H2O+2C4H5ONa═Na2CO3+2C8H5OH
③要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为Cl2+HCO3-═CO2+Cl-+HClO.
(2)已知温下Cu(OH)2的Ksp=2×10-20,又知常温下某CuSO4溶液里c(Cu2+)=0.02mol•L-1.如果要生成Cu(OH)2,则应调整溶液pH大于5.
(3)已知可逆反应FeO(g)+CO(g)?Fe(g)+CO2(g)是炼铁工业中一个重要反应,某温度与平衡常数K的关系如下表:
| T(K) | 933 | 1100 |
| K | 0.68 | 0.40 |
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件:升高温度,混合气体的密度减小(选填“增大”“碱小”或“不变”):当$\frac{n(C{O}_{2})}{n(CO)}$=0.5,混合气体平均相对分子质量为33.3.
7.室温下,下列各组离子一定能大量共存的是( )
| A. | 含有大量Fe3+的溶液中:Ca2+、Na+、Cl-、Al3+ | |
| B. | 滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| C. | 在c(H+)=10-13mol•L-1的溶液中:NO3-、K+、AlO2-、CO32- | |
| D. | 在与铝反应能够产生氢气的溶液中:K+、Fe2+、Cl-、NH4+ |
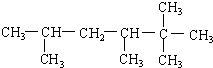 2,2,3,5-四甲基己烷
2,2,3,5-四甲基己烷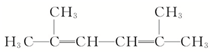 2,5-二甲基-2,4-己二烯.
2,5-二甲基-2,4-己二烯.