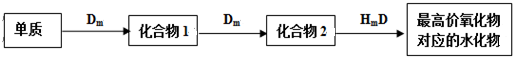
题目内容
6.依据题目要求回答下列问题.(1)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C4H4ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②据上表数据,请你判断下列反应不能成立的是D(填编号)
A、CH3COOH+Na2CO3═NaHCO3+CH3COONa
B、CH3COOH+NaCN═CH4COONa+HCN
C、CO2+H2O+NaClO═NaHCO3+HClO
D、CO2+H2O+2C4H5ONa═Na2CO3+2C8H5OH
③要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为Cl2+HCO3-═CO2+Cl-+HClO.
(2)已知温下Cu(OH)2的Ksp=2×10-20,又知常温下某CuSO4溶液里c(Cu2+)=0.02mol•L-1.如果要生成Cu(OH)2,则应调整溶液pH大于5.
(3)已知可逆反应FeO(g)+CO(g)?Fe(g)+CO2(g)是炼铁工业中一个重要反应,某温度与平衡常数K的关系如下表:
| T(K) | 933 | 1100 |
| K | 0.68 | 0.40 |
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件:升高温度,混合气体的密度减小(选填“增大”“碱小”或“不变”):当$\frac{n(C{O}_{2})}{n(CO)}$=0.5,混合气体平均相对分子质量为33.3.
分析 (1)①弱酸根质量水解程度越大,相同浓度的钠盐溶液的pH越大,则酸根离子结合质子能力越大;
②根据强酸制取弱酸判断.
③HClO和碳酸氢钠不反应,盐酸和碳酸氢钠反应生成二氧化碳;
(2)根据Ksp=c(Cu2+)•[c(OH-)]2=2×10-20,根据Cu2+离子的浓度计算OH-离子的浓度,根据水的离子积常数计算氢离子浓度,并以此计算溶液pH值;
(3)①根据反应方程式FeO(s)+CO2(g)?Fe(s)+CO(g)书写K的表达式;
②根据影响化学平衡常数的因素进行分析,升温平衡常数减小,说明平衡逆向移动,正反应为放热反应.
解答 解:(1)①弱酸根水解程度越大,则酸根离子结合质子能力越大,相同浓度的钠盐溶液的pH越大,根据溶液pH知,CO32-的水解程度最大,则CO32-结合质子能力最强,故答案为:CO32-;
②根据强酸制取弱酸知,
A.醋酸的酸性大于碳酸氢根离子,所以CH3COOH+Na2CO3═NaHCO3+CH3COONa能发生,故不选;
B.醋酸酸性大于氢氰酸,所以CH3COOH+NaCN═CH3COONa+HCN能发生,故不选;
C.碳酸的酸性大于次氯酸,所以CO2+H2O+NaClO═NaHCO3+HClO能发生,故不选;
D.苯酚酸性小于碳酸而大于碳酸氢根离子,所以CO2+H2O+2C6H5ONa═Na2CO3+2C6H5OH不能发生,故选;
故选D.
③HClO和碳酸氢钠不反应,盐酸和碳酸氢钠反应生成二氧化碳,所以导致氯水中HClO浓度增大,离子方程式为Cl2+HCO3-═CO2+Cl-+HClO;
故答案为:Cl2+HCO3-═CO2+Cl-+HClO;
(2)某CuSO4溶液里c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,则应有c(OH-)≥$\sqrt{\frac{2×1{0}^{-20}}{0.02}}$mol/L=10-9mol/L,则c(H+)≤$\frac{1×1{0}^{-14}}{1{0}^{-9}}$mol/L=10-5mol/L,
所以pH≥-lg(10-5)=5,故答案为:5;
(3)①根据反应方程式FeO(s)+CO2(g)?Fe(s)+CO(g)书写K,表达式为K=$\frac{c(CO)}{c(C{O}_{2})}$,故答案为:K=$\frac{c(CO)}{c(C{O}_{2})}$;
②升温平衡常数减小,说明平衡逆向移动,平衡左移时,气体的体积不变,但总质量变小,故混合气体的密度变小;
当$\frac{n(C{O}_{2})}{n(CO)}$=0.5,K=$\frac{n(C{O}_{2})}{n(CO)}$=2,n(CO):c(CO2)=2:1,混合气体平均相对分子质量为$\frac{28×2+44}{2+1}$=33.3.
故答案为:减小;33.3.
点评 本题考查了平衡常数,盐类水解,溶度积常数的计算,题目综合性较强,难度不大,注意把握计算公式的运用、H2CO3、HClO、HCO3-酸性强弱关系.

| A. | 取代,4 mol Cl2 | B. | 加成,2 mol Cl2 | ||
| C. | 加成、取代,2 mol Cl2 | D. | 加成、取代,3 mol Cl2 |
| A. | 澄清的石灰水与盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 钠与水的反应 Na+2H2O═Na++2OH-+H2↑ | |
| C. | 铜片插入硝酸银溶液 Cu+Ag+═Cu2++Ag | |
| D. | 大理石溶于醋酸 CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ |
| A. | 元素A、C的最高价氧化物对应的水化物都是弱酸 | |
| B. | D的单质有毒,且有漂白性,其氢化物比同主族其它元素氢化物的沸点更高 | |
| C. | 元素B和D能形成BD2型的共价化合物 | |
| D. | 元素B的单质能与A的最高价氧化物发生置换反应 |
| A. | 用10 mL的量筒量取4.8 mL的浓硫酸 | |
| B. | 做金属钠实验时,剩余的钠放回原试剂瓶 | |
| C. | 配制FeCl3溶液时,将FeCl3固体溶于盐酸中,然后再用水稀释到所需的浓度 | |
| D. | 欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 |
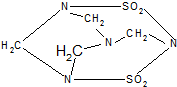 毒鼠强是一种剧毒鼠药.已知毒鼠强的结构简式如图,有关毒鼠强(化学名:四亚甲基二砜四胺)的下列相关说法正确的是( )
毒鼠强是一种剧毒鼠药.已知毒鼠强的结构简式如图,有关毒鼠强(化学名:四亚甲基二砜四胺)的下列相关说法正确的是( )| A. | 毒鼠强属于无机物 | |
| B. | 毒鼠强属于烃 | |
| C. | 毒鼠强分子内含SO2分子因而具有毒性 | |
| D. | 毒鼠强的分子式为C4H8N4S2O4 |
| A. | 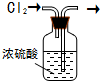 干燥氯气 | B. | 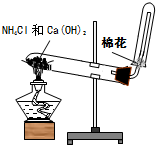 实验室制氨气 | ||
| C. | 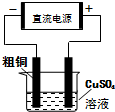 电解精炼铜 | D. | 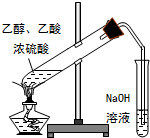 制乙酸乙酯 |