题目内容
8.BaCl2•xH2O中结晶水数目可通过重量法来确定:①称取1.222g样品,置于小烧杯中,加入适量稀盐酸,加热溶解,边搅拌边滴加稀硫酸到沉淀完全,静置;
②过滤并洗涤沉淀;
③将盛有沉淀的滤纸包烘干并中温灼烧;转入高温炉中,反复灼烧到恒重,称得沉淀质量为1.165g.
回答下列问题:
(1)BaCl2的电子式为
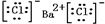 ,①中形成沉淀的离子方程式为SO42-+Ba2+=BaSO4↓;
,①中形成沉淀的离子方程式为SO42-+Ba2+=BaSO4↓;(2)在操作②中,需要先后用稀硫酸和蒸馏水 洗涤沉淀;检验沉淀中氯离子是否洗净的方法是取水洗液于试管中,加入稀硝酸酸化,滴加AgNO3溶液,若无白色浑浊出现,则表明Cl-已经冼净;
(3)③中测定灼烧的容器是坩埚,灼烧时需要用玻璃棒搅拌目的是使沉淀均匀受热,避免飞溅;
(4)计算BaCl2•xH2O中的x=2.
(5)操作③中,如果空气不充足和温度过高,可能会有部分沉淀被滤纸中的碳还原为BaS,这使x的测定结果偏高 (填“偏低”、“偏高”或“不变”).
分析 (1)氯化钡是离子晶体,钡离子和氯离子之间以离子键结合;钡离子与硫酸根离子结合生成硫酸钡沉淀;
(2)应用硫酸与蒸馏水进行进行沉淀洗涤;具体方法是取水洗液于试管中,加入稀硝酸酸化,滴加AgNO3溶液,若无白色浑浊出现,则表明Cl-已经冼净;
(3)固体灼烧时温度较高,一般在坩埚中进行;固体受热不均时会飞溅;
(4)根据硫酸钡质量计算氯化钡质量,进而计算水的质量,根据二者质量之比确定x的值;
(5)部分沉淀被滤纸中的碳还原为BaS,单质固体硫酸钡的质量偏小,测定氯化钡的质量偏小,水的质量偏大.
解答 解:(1)氯化钡是离子晶体,钡离子和氯离子之间以离子键结合,氯化钡的电子式为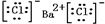 ;钡离子与硫酸根离子结合生成硫酸钡沉淀,其反应的离子方程式为:SO42-+Ba2+=BaSO4↓;
;钡离子与硫酸根离子结合生成硫酸钡沉淀,其反应的离子方程式为:SO42-+Ba2+=BaSO4↓;
故答案为: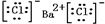 ;SO42-+Ba2+=BaSO4↓;
;SO42-+Ba2+=BaSO4↓;
(2)应用硫酸与蒸馏水进行进行沉淀洗涤,具体方法是取水洗液于试管中,加入稀硝酸酸化,滴加AgNO3溶液,若无白色浑浊出现,则表明Cl-已经冼净;
故答案为:蒸馏水;取水洗液于试管中,加入稀硝酸酸化,滴加AgNO3溶液,若无白色浑浊出现,则表明Cl-已经冼净;
(3)固体灼烧时温度较高,一般在坩埚中进行,则灼烧沉淀的容器是坩埚;固体受热不均时会飞溅,所以要用玻璃棒搅拌固体,使其均匀受热;
故答案为:坩埚;使沉淀均匀受热,避免飞溅;
(4)沉淀1.165g为硫酸钡质量,其物质的量=$\frac{1.165g}{233g/mol}$=0.005mol,故氯化钡晶体中氯化钡的质量=0.005mol×208g/mol=1.04g,含有结晶水的质量=1.222g-1.04g=0.182g,则208:18x=1.04g:0.182g,解得x≈2,
故答案为:2;
(5)部分沉淀被滤纸中的碳还原为BaS,单质固体硫酸钡的质量偏小,测定氯化钡的质量偏小,水的质量偏大,故x的值偏高,故答案为:偏高.
点评 本题考查物质组成的测定,主要涉及电子式、离子方程式、基本实验操作、计算、误差分析等,题目难度中等,分子式的确定是难点,需要学生具备扎实的基础.

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案| A. | x=y=z | B. | x>y=z | C. | x<y=z | D. | x=y<z |
| A. | N2 | B. | NO2 | C. | NH3 | D. | NO |
HCHO+O2$\frac{\underline{\;催化剂\;}}{\;}$CO2+H2O.下列有关说法正确的是( )
| A. | 该反应为吸热反应 | B. | CO2分子中的化学键为非极性键 | ||
| C. | HCHO分子中含δ键又含π键 | D. | 每生成1.8gH2O消耗2.24LO2 |
| A. |  和 和 | B. | CH3CH2CH2OH和CH3CHOHCH3 | ||
| C. |  和 和 | D. |  和 和 |
| A. | pH=3的溶液与pH=11的溶液混合后pH值不一定等于7 | |
| B. | 同浓度的Na2CO3溶液室温时的pH值必定大于60℃的pH值 | |
| C. | 同浓度的钾盐溶液,酸式盐的pH值必定小于对应正盐的pH值 | |
| D. | 因为碳酸的酸性比亚硫酸弱,所以室温下同浓度的碳酸钠溶液的pH值小于亚硫酸钠溶液pH值 |

某小组同学在实验室模拟该流程制纯碱,设计如下:
可供选择的试剂有:6mol•L-1盐酸、6mol•L-1硫酸、浓氨水、生石灰、石灰石、氯化铵、蒸馏水和冰.(夹持仪器略)
请回答:
(1)A装置中所装试剂是6mol/L 盐酸和石灰石,B装置的作用是除去CO2中的HCl.
(2)用相关化学用语说明D装置制取气体的原理氧化钙与水反应放热,使NH3•H2O分解产生NH3溶液中c(OH-)增大,使
NH3+H2O?NH3•H2O?NH4++OH-平衡逆向移动,利于NH3的逸出,CaO与水结合平衡逆向移动.
(3)检验D装置中产生的气体的方法从C中取出D装置导管,将湿润的红色石蕊试纸放于导管口处,若变蓝,则产生的气体为NH3.
(4)根据下表中四种物质的溶解度,回答:
 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 |
②依据上表和工业流程图1,为了从C装置中分离后的溶液中得到更多的副产品NH4Cl,可采取的措施是a、c.
a.加NH3和NaCl b.通入CO2 c.降低温度
(5)C装置中产品X经煅烧得到纯碱,其中常含有少量的NaCl,为测定其纯度,某实验小组设计的以下方案正确的是②、③.
①取纯碱样品ag于试管中,溶解后,加入过量盐酸,用碱石灰吸收产生的气体,碱石灰增重bg.
②取纯碱样品ag于试管中,溶解后,先加入过量硝酸酸化,再滴加过量的AgNO3溶液,产生的沉淀经过滤、洗涤、干燥,称其质量为bg.
③取纯碱样品ag于试管中,溶解后,滴加过量的CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为bg.
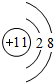 ,C的原子结构示意图是
,C的原子结构示意图是 .
.