题目内容
17.下列叙述正确的是( )| A. | pH=3的溶液与pH=11的溶液混合后pH值不一定等于7 | |
| B. | 同浓度的Na2CO3溶液室温时的pH值必定大于60℃的pH值 | |
| C. | 同浓度的钾盐溶液,酸式盐的pH值必定小于对应正盐的pH值 | |
| D. | 因为碳酸的酸性比亚硫酸弱,所以室温下同浓度的碳酸钠溶液的pH值小于亚硫酸钠溶液pH值 |
分析 A、pH=3的溶液可能是强酸溶液也可能是弱酸溶液,pH=11的溶液可能是强碱溶液也可能是弱碱溶液;
B、温度升高能促进盐的水解;
C、多元弱酸的第一步水解大于第二步水解;
D、碳酸的酸性比亚硫酸弱,则碳酸钠溶液的水解程度更强.
解答 解:A、pH=3的溶液可能是强酸溶液也可能是弱酸溶液,pH=11的溶液可能是强碱溶液也可能是弱碱溶液,当两者均为强酸和强碱溶液时,则混合后溶液的pH=7,但当两者中有一种是弱电解质,则混合后溶液的pH不等于7,故A正确;
B、温度升高能促进盐的水解,故温度越高,碳酸钠溶液的pH越大,故B错误;
C.如果酸式钾盐是弱酸酸式钾盐,而正盐是强酸钾盐,如同浓度的碳酸氢钾溶液与硫酸钾溶液相比,碳酸氢钾的pH大于硫酸钾,故C错误;
D、根据酸越弱,则对应的盐就越水解可知,由于碳酸的酸性比亚硫酸弱,则碳酸钠溶液的水解程度比亚硫酸钠的水解程度更大,即pH更大,故D错误;
故选A.
点评 本题考查了弱电解质的电离、盐类水解以及水解平衡移动、pH相关问题,题目难度中等.

练习册系列答案
相关题目
12.科学家在研究探索中不断发现新的物质,据报道,1996年科学家在宇宙中发现了H3分子,那么H3和H2属于( )
| A. | 同位素 | B. | 同分异构体 | C. | 同系物 | D. | 同素异形体 |
9.在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,表明反应:A(s)+2B(g)?C(g)+D(g)已达平衡的是( )
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | B物质的相对分子质量 | D. | 气体的总物质的量 |
6. 把一块镁铝合金投入到1mol/L酸中,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如图所示,下列说法中错误的是( )
把一块镁铝合金投入到1mol/L酸中,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如图所示,下列说法中错误的是( )
 把一块镁铝合金投入到1mol/L酸中,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如图所示,下列说法中错误的是( )
把一块镁铝合金投入到1mol/L酸中,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如图所示,下列说法中错误的是( )| A. | 盐酸的体积为80ml | B. | a的取值范围为0≤a<50 | ||
| C. | n(Mg2+)<0.025mol | D. | 当a值为30时,b值为0.01 |

 ,①中形成沉淀的离子方程式为SO42-+Ba2+=BaSO4↓;
,①中形成沉淀的离子方程式为SO42-+Ba2+=BaSO4↓;
 .
. 也可与Ⅲ发生类似反应③的反应,生成有机物V,V的结构简式是
也可与Ⅲ发生类似反应③的反应,生成有机物V,V的结构简式是 .
.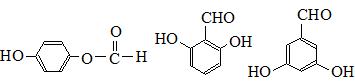 (任写一种).
(任写一种). .
.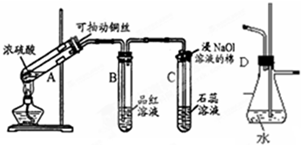 根据如图所示实验回答下列问题:
根据如图所示实验回答下列问题: