题目内容
18.侯氏制碱法制取纯碱的生产流程如图1所示:
某小组同学在实验室模拟该流程制纯碱,设计如下:
可供选择的试剂有:6mol•L-1盐酸、6mol•L-1硫酸、浓氨水、生石灰、石灰石、氯化铵、蒸馏水和冰.(夹持仪器略)
请回答:
(1)A装置中所装试剂是6mol/L 盐酸和石灰石,B装置的作用是除去CO2中的HCl.
(2)用相关化学用语说明D装置制取气体的原理氧化钙与水反应放热,使NH3•H2O分解产生NH3溶液中c(OH-)增大,使
NH3+H2O?NH3•H2O?NH4++OH-平衡逆向移动,利于NH3的逸出,CaO与水结合平衡逆向移动.
(3)检验D装置中产生的气体的方法从C中取出D装置导管,将湿润的红色石蕊试纸放于导管口处,若变蓝,则产生的气体为NH3.
(4)根据下表中四种物质的溶解度,回答:
 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 |
②依据上表和工业流程图1,为了从C装置中分离后的溶液中得到更多的副产品NH4Cl,可采取的措施是a、c.
a.加NH3和NaCl b.通入CO2 c.降低温度
(5)C装置中产品X经煅烧得到纯碱,其中常含有少量的NaCl,为测定其纯度,某实验小组设计的以下方案正确的是②、③.
①取纯碱样品ag于试管中,溶解后,加入过量盐酸,用碱石灰吸收产生的气体,碱石灰增重bg.
②取纯碱样品ag于试管中,溶解后,先加入过量硝酸酸化,再滴加过量的AgNO3溶液,产生的沉淀经过滤、洗涤、干燥,称其质量为bg.
③取纯碱样品ag于试管中,溶解后,滴加过量的CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为bg.
分析 侯氏制碱法制取纯碱反应原理可用下列化学方程式表示:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O根据反应原理,实验操作过程为:先制得NH3(右边装置)和CO2(左边装置),B装置除去二氧化碳中的氯化氢;氯化氢能够与碳酸氢钠反应生成二氧化碳,再将制得的气体依次通入C装置中饱和食盐水中即得碳酸氢钠晶体,再加热碳酸氢钠晶体就可以得到纯碱,
(1)A装置为制取二氧化碳的装置,实验室用碳酸钙和盐酸反应制取二氧化碳;
(2)D装置为制取氨气的装置,选用浓氨水、生石灰制取,根据一水合氨为弱碱的电离平衡分析制取气体的原理;
(3)D装置为制取氨气的装置,根据氨气的性质选择检验的方法;
(4)根据溶解度表分析,30℃左右碳酸氢钠溶解度最小,分离沉淀的方法为过滤,C装置中二氧化碳、氨气和水反应生成碳酸氢钠;根据氨气溶于水后生成氨水,氨水电离成铵根,增大铵根的浓度有利于氯化铵的析出来分析,根据同离子效应分析氯离子的影响,根据温度对溶解度的影响分析;
(5)①根据碳守恒,依据碱石灰增重测纯度,未考虑水蒸气的影响;②根据氯元素守恒测定NaCl含量;③根据碳元算守恒测碳酸钠质量.
解答 解:侯氏制碱法制取纯碱反应原理可用下列化学方程式表示:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O根据反应原理,实验操作过程为:先制得NH3(右边装置)和CO2(左边装置),B装置除去二氧化碳中的氯化氢;再将制得的气体依次通入C装置中饱和食盐水中即得碳酸氢钠晶体,再加热碳酸氢钠晶体就可以得到纯碱,
(1)实验室通常用稀盐酸与大理石(或石灰石)反应制取二氧化碳,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,CaCO3+2HCl=CaCl2+H2O+CO2↑,所以A装置中所装试剂是6mol/L 盐酸、石灰石,B装置除去二氧化碳中的氯化氢,氯化氢能够与碳酸氢钠反应生成二氧化碳,
故答案为:6mol/L 盐酸;石灰石;除去CO2中的HCl;
(2)D装置为制取氨气的装置,选用浓氨水、生石灰制取,氧化钙与水反应放热,使NH3•H2O分解产生NH3,溶液中c(OH-)增大,使NH3+H2O?NH3•H2O?NH4++OH-平衡逆向移动,利于NH3的逸出,CaO与水结合平衡逆向移动,
故答案为:氧化钙与水反应放热,使NH3•H2O分解产生NH3;溶液中c(OH-)增大,使NH3+H2O?NH3•H2O?NH4++OH-平衡逆向移动,利于NH3的逸出,CaO与水结合平衡逆向移动;
(3)D装置为制取氨气的装置,氨气易溶于水,为碱性气体,可使湿润的红色石蕊试纸变蓝,利用该性质检验D装置中产生的气体,所以操作为:从C中取出D装置导管,将湿润的红色石蕊试纸放于导管口处,若变蓝,则产生的气体为NH3,
故答案为:从C中取出D装置导管,将湿润的红色石蕊试纸放于导管口处,若变蓝,则产生的气体为NH3;
(4)①根据溶解度表分析,30℃左右碳酸氢钠溶解度11.1g最小,所以沉淀池中在30℃C时析出的物质X是NaHCO3,固液分离的方法为过滤,C装置中二氧化碳、氨气和水反应生成碳酸氢钠,反应为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,
故答案为:NaHCO3;过滤;NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
②a.氨气溶于水后生成氨水,氨水电离成铵根,增大铵根的浓度有利于氯化铵的析出来,加入氯化钠,增大溶液中氯离子浓度,有利于氯化铵的析出来,所以选项a正确;
b.通入二氧化碳对氯化铵的析出无影响,故b错误;
降低温度,可使氯化铵的溶解度降低,有利于氯化铵的析出来,所以选项C正确;
故答案为:a、c;
(5)①水蒸气会进入碱石灰,导致干燥管质量增加,测定的生成二氧化碳的质量偏大,碳酸钠的质量偏大,故①错误;
②取纯碱样品ag于试管中,溶解后,先加入过量硝酸酸化,再滴加过量的AgNO3溶液,产生氯化银沉淀,根据氯元素守恒,n(Cl)=n(AgCl)=n(NaCl),能测定其纯度,故②正确;
③取纯碱样品ag于试管中,溶解后,滴加过量的CaCl2溶液,沉淀经过滤、洗涤、干燥,得到碳酸钙,其质量为bg,根据碳元素守恒,n(CaCO3)=n(Na2CO3),能测定其纯度,故②正确;
故答案为:②、③.
点评 本题以侯氏制碱法的原理为切入点,分别考查药品的选用、操作过程分析、实验装置评价、化学计算、化工生产原理等知识,题目难度中等,正确分析题干信息为解答关键,试题有利于培养学生的分析、理解能力及化学实验能力.

 名校课堂系列答案
名校课堂系列答案| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | B物质的相对分子质量 | D. | 气体的总物质的量 |
 把一块镁铝合金投入到1mol/L酸中,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如图所示,下列说法中错误的是( )
把一块镁铝合金投入到1mol/L酸中,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如图所示,下列说法中错误的是( )| A. | 盐酸的体积为80ml | B. | a的取值范围为0≤a<50 | ||
| C. | n(Mg2+)<0.025mol | D. | 当a值为30时,b值为0.01 |
| A. | I2Cl6 | B. | ICl5 | C. | HClO | D. | KIO3 |

①S、SO2 ②AlCl3、Al(OH)3 ③H2S、S ④Fe、FeCl2.
| A. | ①②③ | B. | ②③ | C. | ②④ | D. | ①③④ |
| 加入物质 | HCl(aq) | FeCl3 | NaOH | HCOONa | C2H5OH |
| 溶液的pH | 3 | 4 | 10 | 11 | 未确定 |
| 水的电离程度 | α1 | α2 | α3 | α4 | α5 |
| A. | α3>α1>α5>α2>α4 | B. | α4>α2>α5>α1>α3 | C. | α4>α2>α5>α3>α1 | D. | α1>α3>α5>α2>α4 |
| A. | CH3CH2CHBrCH3与氢氧化钠的乙醇溶液反应 | |
| B. | 甲苯在催化剂作用下与Cl2发生苯环上的取代反应 | |
| C. | 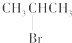 与NaOH的醇溶液共热反应 与NaOH的醇溶液共热反应 | |
| D. | 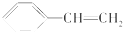 在催化剂存在下与H2完全加成 在催化剂存在下与H2完全加成 |
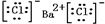 ,①中形成沉淀的离子方程式为SO42-+Ba2+=BaSO4↓;
,①中形成沉淀的离子方程式为SO42-+Ba2+=BaSO4↓;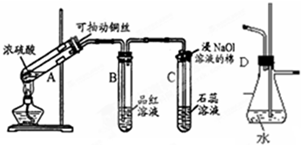 根据如图所示实验回答下列问题:
根据如图所示实验回答下列问题: