题目内容
18.pH相同的氨水、NaOH溶液和Ba(OH)2溶液,分别用蒸馏水稀释到原来的x倍、y倍、z倍,稀释后三种溶液的pH相同,则x、y、z的关系是( )| A. | x=y=z | B. | x>y=z | C. | x<y=z | D. | x=y<z |
分析 NaOH、Ba(OH)2是强电解质,一水合氨是弱电解质,所以pH相同的氨水、NaOH溶液和Ba(OH)2溶液,物质的量浓度c(氨水)>c(NaOH)=2c[Ba(OH)2],稀释过程中,一水合氨继续电离出氢氧根离子,如果稀释相同的倍数,则氨水中c(OH-)最大、NaOH和Ba(OH)2溶液中c(OH-)相等,要使稀释后三种溶液中pH相等,则n(OH-)多的应该稀释倍数大,据此分析解答.
解答 解:NaOH、Ba(OH)2是强电解质,一水合氨是弱电解质,所以pH相同的氨水、NaOH溶液和Ba(OH)2溶液,物质的量浓度c(氨水)>c(NaOH)=2c[Ba(OH)2],稀释过程中,一水合氨继续电离出氢氧根离子,如果稀释相同的倍数,则氨水中c(OH-)最大、NaOH和Ba(OH)2溶液中c(OH-)相等,要使稀释后三种溶液中pH相等,则n(OH-)多的应该稀释倍数大,所以氨水稀释倍数最大,NaOH和Ba(OH)2溶液稀释倍数相等,所以x>y=z,故选B.
点评 本题考查弱电解质的电离,明确弱电解质电离特点是解本题关键,采用逆向思维分析解答即可,注意:pH相等的NaOH溶液和Ba(OH)2溶液中c(OH-)相等但溶质浓度不等,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列离子方程式书写正确的是( )
| A. | 硫酸铜溶液与氢氧化钡溶液混合:Cu2++2 OH-=Cu(OH)2↓ | |
| B. | 用小苏打(NaHCO3)治疗胃酸(主要成分是盐酸)过多:CO32-+H+═CO2↑+H2O | |
| C. | 将少量二氧化碳气体通入澄清石灰水中:2OH-+CO2═CO32-+H2O | |
| D. | 稀硫酸与氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓ |
9.体积为V(mL)、密度为ρ(g/cm3)的溶液中,含有摩尔质量为M(g/mol)的溶质m(g),其物质的量浓度为c(mol/L),溶质的质量分数为a%.下列有关关系式不正确的是( )
| A. | m=Vρa% | B. | c=1000ρaM | C. | c=$\frac{1000m}{VM}$ | D. | a%=$\frac{cM}{1000ρ}$×100% |
6.下列叙述正确的是( )
| A. | 直径介于1nm~100 nm之间的微粒称为胶体 | |
| B. | 电泳现象可证明胶体带电 | |
| C. | 用盐析法可分离皂化反应后所得的产物 | |
| D. | 用含1mol FeCl3的溶液可制得6.02×1023个Fe(OH)3胶体粒子 |
13.仅用一种试剂便可以将苯、苯酚、四氯化碳、乙醛等4种无色液体进行鉴别,这种试剂是( )
| A. | 银氨溶液 | B. | 新制的氢氧化铜 | C. | 溴水 | D. | 氢氧化钠溶液 |
3.已知弱酸的电离平衡常数如下表:下列选项正确的是( )
| 弱酸 | H2CO3 | 水杨酸(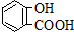 ) ) |
| 电离平衡常数(925℃) | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=1.3×10-3 Ka2=1.1×10-11 |
| A. | 常温下,等浓度、等体积的NaHCO3溶液pH小于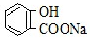 溶液pH 溶液pH | |
| B. | 常温下,等浓度、等体积的Na2CO3溶液和  溶液中所含离子总数前者小于后者 溶液中所含离子总数前者小于后者 | |
| C. |  +2NaHCO3→ +2NaHCO3→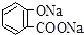 +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. | 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1的原因之一是能形成分子内氢键 |
10.下列离子方程式不正确的是( )
| A. | 向硅酸钠溶液中通入少量CO2气体 SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| B. | 将Cu片插入FeCl3溶液中 Cu+Fe3+═Fe2++Cu2+ | |
| C. | 向烧碱溶液中滴加少量Al2(SO4)3溶液 Al3++4OH-═[Al(OH)4]- | |
| D. | 将Ag丝插入NaNO3和H2SO4的混合液中 3Ag+4H++NO3-═3Ag++NO↑+2H2O |

 ,①中形成沉淀的离子方程式为SO42-+Ba2+=BaSO4↓;
,①中形成沉淀的离子方程式为SO42-+Ba2+=BaSO4↓;