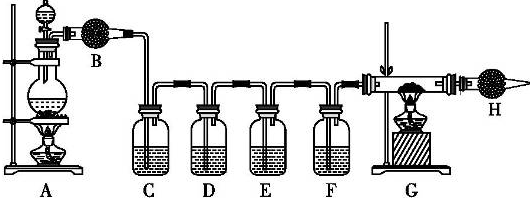
题目内容
3.A、B、C、D四种元素的原子序数均小于18,其最高正价数依次为1,4,5,7,已知B的原子核外次外层电子数为2.A、C原子的核外次外层电子数为8.D元素的最高价氧化物对应的水化物是已知含氧酸中最强酸,则:(1)A、B、C、D的名称分别是钠、碳、磷、氯.
(2)A的离子结构示意图是
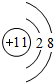 ,C的原子结构示意图是
,C的原子结构示意图是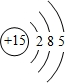 .
.(3)C、D的气态氢化物稳定性强弱是HCl>PH3.
分析 A、B、C、D四种元素的原子序数均小于18,B的原子核外次外层电子数为2,即B原子核外有2个电子层,最高正化合价为+4,故B为碳元素;A、C原子的核外次外层电子数为8,均处于第三周期,最高正化合价依次为+1、+5,故A为Na、C为P元素;D元素最高价为+7,最高价氧化物对应的水化物是已知含氧酸中最强酸,则D为Cl,据此解答.
解答 解:A、B、C、D四种元素的原子序数均小于18,B的原子核外次外层电子数为2,即B原子核外有2个电子层,最高正化合价为+4,故B为碳元素;A、C原子的核外次外层电子数为8,均处于第三周期,最高正化合价依次为+1、+5,故A为Na、C为P元素;D元素最高价为+7,最高价氧化物对应的水化物是已知含氧酸中最强酸,则D为Cl.
(1)由上述分析可知,A、B、C、D的名称分别是钠、碳、磷、氯,故答案为:钠;碳;磷;氯;
(2)A为钠元素,则钠离子的质子数为11,核外电子数为10,有2个电子层,最外层电子数为8,其离子结构示意图为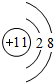 ;
;
C为磷元素,其质子数为15,有3个电子层,最外层电子数为5,其原子结构示意图为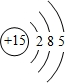 ,
,
故答案为: ;
;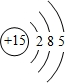 ;
;
(3)非金属性Cl>P,故氢化物稳定性:HCl>PH3,故答案为:HCl;PH3.
点评 本题考查位置结构性质的关系,注侧重对化学用语的考查,利用已知信息推出各元素是解答本题的关键,题目难度不大.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
13.仅用一种试剂便可以将苯、苯酚、四氯化碳、乙醛等4种无色液体进行鉴别,这种试剂是( )
| A. | 银氨溶液 | B. | 新制的氢氧化铜 | C. | 溴水 | D. | 氢氧化钠溶液 |
14.已知H2A在水中存在以下平衡:H2A?H++HA-,HA-?H++A2-.某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性.则有关该混合溶液的说法中,一定正确的是( )
| A. | NaHA溶液一定呈酸性 | B. | c(H+)•c(OH-)=1×10-14x | ||
| C. | c(Na+)=c(K+) | D. | c(Na+)+c(K+)=0.05 mol/L |
11.下列实验操作使测定(或配制)结果偏高的是( )
| A. | 配制一定物质的量浓度的溶液,定容时俯视刻度线 | |
| B. | 测量一包固体的质量,将药品放在右盘,砝码放在左盘,并需移动游码使之平衡 | |
| C. | 中和滴定用的锥形瓶加入待测液后,再加少量蒸馏水稀释 | |
| D. | 在敞口容器中测量氢氧化钠和稀盐酸反应的中和热 |
18.下列叙述正确的是( )
| A. | 稀硝酸、稀硫酸均能将木炭氧化成二氧化碳 | |
| B. | Na2O2与水反应,红热的Fe与水蒸气反应均能生成气体 | |
| C. | Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物 | |
| D. | NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体 |
12.科学家在研究探索中不断发现新的物质,据报道,1996年科学家在宇宙中发现了H3分子,那么H3和H2属于( )
| A. | 同位素 | B. | 同分异构体 | C. | 同系物 | D. | 同素异形体 |
 ,①中形成沉淀的离子方程式为SO42-+Ba2+=BaSO4↓;
,①中形成沉淀的离子方程式为SO42-+Ba2+=BaSO4↓;