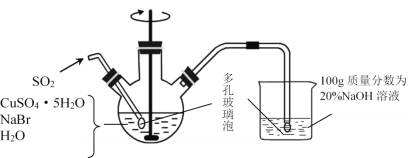
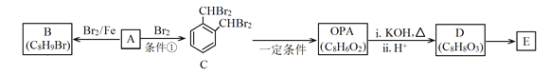
题目内容
【题目】H2SO3水溶液中存在电离平衡H2SO3![]() H++ HSO3- 和HSO3-
H++ HSO3- 和HSO3-![]() H++ SO32-,若对H2SO3溶液进行如下操作,则结论正确的是:( )
H++ SO32-,若对H2SO3溶液进行如下操作,则结论正确的是:( )
A.通入氯气,溶液中氢离子浓度增大
B.通入过量H2S,反应后溶液pH减小
C.加入氢氧化钠溶液,平衡向右移动,pH变小
D.加入氯化钡溶液,平衡向右移动,会产生亚硫酸钡沉淀
【答案】A
【解析】
A、氯气和亚硫酸会发生氧化还原反应Cl2+H2SO3+H2O=4H++SO42-+2Cl-,溶液中氢离子浓度增大,A正确;
B、亚硫酸和硫化氢发生氧化还原反应H2SO3+2H2S=3S↓+3H2O,通入硫化氢后抑制亚硫酸电离,导致氢离子浓度减小,溶液的pH增大,B错误;
C、加入氢氧化钠溶液,发生反应OH-+H+=H2O,平衡向正向移动,但氢离子浓度减小,溶液的pH增大,C错误;
D、氯化钡和亚硫酸不反应,不影响亚硫酸的电离,不会产生亚硫酸钡沉淀,D错误。
答案选A。

 名校课堂系列答案
名校课堂系列答案【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意如下:
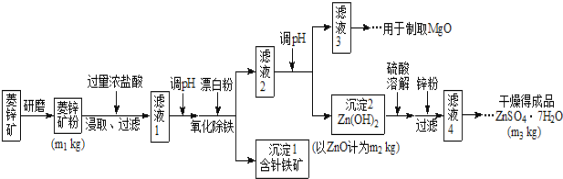
(1)将菱锌矿研磨成粉的目的是_______________________。
(2)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是______________。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为________________
Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
开始沉淀的pH | 10.4 | 6.4 | — | — |
沉淀完全的pH | 12.4 | 8.0 | — | — |
开始溶解的pH | — | 10.5 | — | — |
工业上从“滤液3”制取MgO过程中,最合适的反应物是______________(选填序号)。
A、大理石粉 B、石灰乳 C、纯碱溶液 D、烧碱溶液
“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(4)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。
【题目】已知:K3[Fe(CN)6]溶液是检验Fe2+的试剂,若溶液中存在Fe2+,将产生蓝色沉淀。将0.2mol/L的KI溶液和0.05mol/LFe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是
2Fe2++I2”的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A.①B.②和④C.③和④D.①和②