题目内容
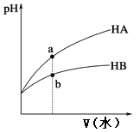
【题目】从宏观现象探究微观本质是重要的化学学科素养。以亚硫酸纳(Na2SO3)为实验对象,探究其性质。实验如下:
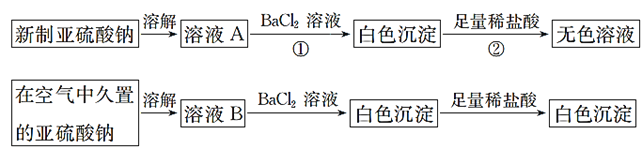
(1)写出上述实验中②的离子方程式:__________。
(2)通过上述实验可知,在空气中久置的亚硫酸纳固体中会混有____________ (填化学式)。
(3)亚硫酸纳晶体样品若变质,下列说法错误的是 _______________。
A.晶体表面变黄 B.其水溶液pH 将减小 C.其样品质量将增加
(4)将碳酸纳溶液加热到40 ℃通入二氧化硫饱和后,再加入等量的碳酸钠溶液,在避免与空气接触的情况下结晶可制得亚硫酸钠,该制备过程总反应的化学方程式 ___________。
【答案】BaSO3+2H+=Ba2++SO2+H2O Na2SO4 A Na2CO3+SO2=Na2SO3+CO2
【解析】
新制亚硫酸钠溶解得到溶液A,加入氯化钡溶液生成亚硫酸钡白色沉淀,加入足量稀盐酸沉淀溶解得到氯化钡溶液,在空气中久置的亚硫酸钠被空气部分氧化,溶解得到溶液B加入氯化钡溶液生成白色沉淀,加入足量稀盐酸沉淀部分溶解,亚硫酸钠部分被氧化成硫酸钠,据此回答问题。
(1)由分析可知,②反应的离子方程式BaSO3+2H+=Ba2++SO2+H2O,
故答案为:BaSO3+2H+=Ba2++SO2+H2O;
(2)通过上述实验可知,在空气中久置的亚硫酸钠固体中会混有Na2SO4,
故答案为:Na2SO4;
(3)A.亚硫酸钠固体是白色晶体,硫酸钠也是白色晶体,不会变黄,故A错误,符合题意;
B.亚硫酸钠溶液中亚硫酸根离子水解使溶液显碱性,氧化成硫酸钠后,溶液显中性,亚硫酸钠部分氧化后其溶液pH值降低,故B正确,不符合题意;
C.亚硫酸钠被氧化成硫酸钠的过程吸收氧气,固体质量增加,故C正确,不符合题意;
故选:A。
(4) 二氧化硫的水溶液具有中等强度酸性,二氧化碳的水溶液酸性较弱,这说明亚硫酸的酸性强于碳酸,强酸能制取弱酸,所以反应方程式为Na2CO3+SO2=Na2SO3+CO2 ,
故答案为:Na2CO3+SO2=Na2SO3+CO2。

【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意如下:
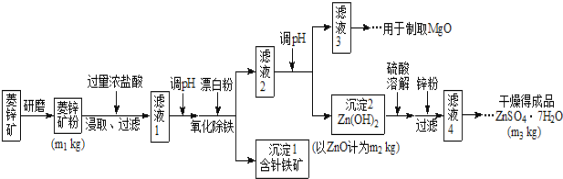
(1)将菱锌矿研磨成粉的目的是_______________________。
(2)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是______________。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为________________
Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
开始沉淀的pH | 10.4 | 6.4 | — | — |
沉淀完全的pH | 12.4 | 8.0 | — | — |
开始溶解的pH | — | 10.5 | — | — |
工业上从“滤液3”制取MgO过程中,最合适的反应物是______________(选填序号)。
A、大理石粉 B、石灰乳 C、纯碱溶液 D、烧碱溶液
“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(4)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。