题目内容
【题目】恒温,不同pH下,Fe(OH)3(s)与Cu(OH)2(s)分别在溶液中达到溶解平衡时,金属阳离子浓度随pH的变化如图所示。下列判断正确的是
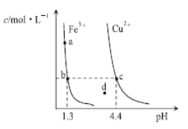
A.加适量盐酸可使溶液中c(Fe3+)由a点变到b点
B.c、d两点代表的溶液中,c(H+) c(OH-)不相等
C.a、b两点时,Fe(OH)3在溶液中均达到饱和
D.Ksp[Fe(OH)3] >Ksp[Cu(OH)2]
【答案】C
【解析】
曲线上的任意点均表示在该pH下的饱和溶液,外加相关物质发生反应破坏溶解平衡都会使溶液中微粒浓度发生变化,pH=1.3时对应c(Fe3+)与pH=4.4时对应c(Cu2+)相等,以此判断溶度积。
A.加入盐酸将会使溶液pH减小,c(Fe3+)不能实现由a点变到b点,故A错误;
B.因c(H+) c(OH-)=KW,温度不变的情况下,KW不变,故B错误;
C.a、b两点均处于沉淀溶解平衡曲线上,故两点均代表溶液达到饱和,故C正确;
D.b点:![]() ,c点:
,c点:![]() ,因b点c(Fe3+)=c点c(Cu2+),故
,因b点c(Fe3+)=c点c(Cu2+),故![]() ,故D错误;
,故D错误;
故答案为:C。

【题目】碳酸钾与碳酸氢钾都是重要的化学试剂与工业原料,具有广泛的用途.
(1)将碳酸钾、石灰石和二氧化硅进行高温煅烧,可得到组成为K2OCaO6SiO2的钾玻璃,同时排出CO2.若制造5.1kg钾玻璃,排放的CO2在标准状况下的体积是_____L.
(2)已知亚硫酸的酸性强于碳酸.工业上用碳酸钾与碳酸氢钾的混合溶液吸收SO2,充分反应后,所得溶液组成如下表:
物质 | K2CO3 | KHCO3 | K2SO3 |
质量(kg) | 55.2 | 120.0 | 63.2 |
计算原吸收液中碳酸钾与碳酸氢钾的物质的量之比_______________.
(3)根据上表中的数据,计算上表的混合溶液还能吸收SO2的最大质量(不计SO2的溶解)._____________
(4)将热的浓CuSO4溶液与K2CO3溶液混合,析出物中有一种蓝色粒状晶体(不含结晶水),式量为376,其中钾元素的质量分数为0.104.取0.02mol该晶体溶于足量的稀盐酸中,没有气体产生,再加入BaCl2,产生9.32g白色沉淀,通过计算推断晶体的化学式.___