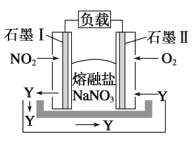
题目内容
【题目】工业上以铬铁矿(主要成分为FeOCr2O3)、碳酸钠、氧气、和硫酸为原料生产重铬酸钠(Na2Cr2O72H2O),其主要反应为:
(1)4FeOCr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(2)2Na2CrO4+H2SO4![]() Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
A. 反应(1)和(2)均为氧化还原反应
B. 反应(1)的氧化剂是O2,还原剂是FeOCr2O3
C. 高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4
D. 反应(1)中每生成1molNa2CrO4时电子转移3mol
【答案】B
【解析】试题分析:A、反应(2)中各元素的化合价都未发生变化,所以不是氧化还原反应,错误;B、反应(1)中,O元素的化合价从0价降低到-2价,所以氧气是氧化剂,FeO·Cr2O3中Fe、Cr元素的化合价均升高,所以FeO·Cr2O3是还原剂,正确;C、根据氧化剂的氧化性大于氧化产物的氧化性,所以高温下,O2的氧化性比Fe2O3、Na2CrO4都强,错误;D、反应(1)中每生成1molNa2CrO4时,则消耗7/8mol氧气,电子转移7/8mol×4=3.5mol,错误,答案选B。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】高铁酸钠(Na2FeO4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。实验室以石墨和铁钉为电极,以不同浓度的NaOH溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下:
c(NaOH) | 阴极现象 | 阳极现象 |
1 mol·L-1 | 产生无色气体 | 产生无色气体,10min内溶液颜色无明显变化 |
10 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,3min后溶液变为浅紫红色,随后逐渐加深 |
15 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,1min后溶液变为浅紫红色,随后逐渐加深 |
下列说法不正确的是

A. a为铁钉,b为石墨
B. 阴极主要发生反应:2H2O + 2e-=== H2↑+ 2OH-
C. 高浓度的NaOH溶液,有利于发生Fe-6e-+ 8OH-=== FeO42-+ 4H2O
D. 制备Na2FeO4时,若用饱和NaCl溶液,可有效避免阳极产生气体