题目内容
【题目】甲烷在日常生活及有机合成中用途广泛。某研究小组研究甲烷在高温下气相裂解反应的原理及其应用。
(1)已知CH4(g)+2O2(g)=CO2(g)+2H2O △H=- Q1kJ·mol-1
C2H2(g)+O2(g)=2CO2(g)+H2O(l) △H=- Q2kJ·mol-1
H2(g)+ ![]() O2=(g)=H2O(l) △H=- Q3kJ·mol-1
O2=(g)=H2O(l) △H=- Q3kJ·mol-1
则甲烷气相裂解反应:2CH4(g)=C2H2(g)+3H2(g)的△H=____________kJ·mol-1
(2)该研究小组在研究过程中得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。
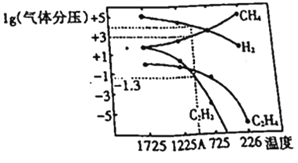
①T1℃时,向2L恒容密闭容器中充入0.3molCH4,发生反应2CH4(g) ![]() C2H6(g)+2H2 (g),达到平衡时,测得c(C2H4)=c(CH4)。该反应达到平衡时,CH4的转化率为_________________。
C2H6(g)+2H2 (g),达到平衡时,测得c(C2H4)=c(CH4)。该反应达到平衡时,CH4的转化率为_________________。
②对上述平衡状态,若改变温度至T2℃,经10s后再次达到平衡,c(CH4)=2c(C2H4),则10s内C2H4平均反应速率r(C2H4) =__________,上述变化过程中T1______T2(填“>”或“<”),判断理由是_________________。
③对于容器中发生的2CH4(g)![]() C2H2(g)+3H2(g),列式计算该反应在图中A点温度时的平衡常数K_____(用平衡分压代替平衡浓度);(已知1g0.05=-1.3)。若只改变一个反应条件使该反应的平衡常数的K值变大。则该条件是:_________(填序号)
C2H2(g)+3H2(g),列式计算该反应在图中A点温度时的平衡常数K_____(用平衡分压代替平衡浓度);(已知1g0.05=-1.3)。若只改变一个反应条件使该反应的平衡常数的K值变大。则该条件是:_________(填序号)
A.可能减小了C2H2的浓度 B.一定是升高了温度
C.可能增大了反应体系的压强 D.可能使用了催化剂
【答案】 (3Q3+Q2-2Q1) 66.7% 0.00125mol·L-1·S-1 > 从图象判断出该反应为吸热反应,对比T1℃到T2℃,CH4浓度增大,说明平衡逆向移动,则T1>T2 5×104 B
【解析】本题主要考查影响化学平衡的外界因素及有关化学平衡的计算。
(1)将已知热化学方程式分别表示为①、②、③,3③+②-2①得甲烷气相裂解反应:2CH4(g)=C2H2(g)+3H2(g)的△H=(3Q3+Q2-2Q1)kJ·mol-1。
(2) ①达到平衡时,由碳元素守恒可得c(C2H4)=c(CH4)=0.1mol,CH4的转化率为0.2mol/0.3mol=66.7%。
②由碳元素守恒可得c(CH4)=2c(C2H4)=0.15mol, r(C2H4)=r(CH4)/2=0.05/2/2/10mol·L-1·S-1=0.00125mol·L-1·S-1,上述变化过程中T1>T2,判断理由是从图象判断出该反应为吸热反应,对比T1℃到T2℃,CH4浓度增大,说明平衡逆向移动,则T1>T2。
③该反应在图中A点温度时CH4(g)、C2H2(g)、H2(g)的平衡分压分别为103、0.05、104,2CH4(g)![]() C2H2(g)+3H2(g),对应的平衡常数K=1012×0.05/106= 5×104。
C2H2(g)+3H2(g),对应的平衡常数K=1012×0.05/106= 5×104。
若只改变一个反应条件使该反应的平衡常数的K值变大。则该条件是:B。理由:A.温度不变,K不变;B. 从图象判断出该反应为吸热反应,升温平衡右移,K增大;C. 温度不变,K不变;D. 温度不变,K不变。故选B。

【题目】苯甲酸是常用的防腐剂和重要的医药原料。一种药用苯甲酸的制备方法如下:
Ⅰ.在反应罐中加入甲苯、饱和KMnO4溶液、Fe2O3(催化剂),加热、回流数小时,充分反应。
Ⅱ.反应结束后,改为蒸馏装置。加热蒸馏,直至冷凝管壁不再出现油珠。
Ⅲ.将反应罐中的混合物趁热过滤,滤渣用少量热水洗涤。
Ⅳ.向滤液中滴加浓盐酸酸化至pH=2,抽滤,用少量水洗涤,干燥得苯甲酸粗品。
Ⅴ.将粗苯甲酸加入……,结晶、洗涤、过滤,得到药用纯苯甲酸。
已知:相关物质的溶解度(g/mL)
温度(℃) | 25 | 50 | 60 | |
苯甲酸 | 在水中 | 0.0034 | 0.0085 | 0.0095 |
在乙醇中 | 0.4 | 0.7 | 1 | |
氯化钾 | 在乙醇中 | 难溶 | ||
(1)Ⅰ中发生的主要反应为:![]() (未配平),则Ⅳ中发生反应的离子方程式为______。
(未配平),则Ⅳ中发生反应的离子方程式为______。
(2)Ⅱ中蒸馏的目的是______。
(3)Ⅲ中趁热过滤的目的是______。
(4)将Ⅴ中操作补充完整:______。