题目内容
9. 已知A、B、C、D、E、F都是元素周期表中前36号的元素,它们的原子序数依次增大.A的一种单质是自然界硬度最大的物质,B是地壳中含量最多的元素,C的单质能从B的一种氢化物中置换出B的一种单质,D是人体骨骼中的常见元素,D的氢氧化物常用来检验A和B形成的一种化合物,F的原子序数比E大1,F是Ⅷ族元素中原子序数最小的一种元素.
已知A、B、C、D、E、F都是元素周期表中前36号的元素,它们的原子序数依次增大.A的一种单质是自然界硬度最大的物质,B是地壳中含量最多的元素,C的单质能从B的一种氢化物中置换出B的一种单质,D是人体骨骼中的常见元素,D的氢氧化物常用来检验A和B形成的一种化合物,F的原子序数比E大1,F是Ⅷ族元素中原子序数最小的一种元素.(1)E的基态原子电子排布式为1s22s22p63s23p63d54s2,比较F和 E的各级电离能后发现,气态E2再失去一个电子比气态F2+再失去一个电子难,其原因是Mn2+的电子排布成半充满状态,相对于Fe2+较为稳定.
(2)写出 DA2的电子式
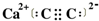 .
.(3)DC2的一个晶胞如右图所示,则图中实心球表示D还是C?答:Ca(填元素名称).该晶体的密度为a g/cm3,则晶胞的体积是$\frac{78×4}{a{N}_{A}}$cm(只要求列出算式).
(4)AB32-离子的空间立体构型为平面正三角形,AB气体在配合物中常作为配体,如近年来开始使用的一种新型汽油防震剂F(AB)5,该化合物中F元素的化合价为0.
分析 A的一种单质是自然界硬度最大的物质是金刚石,所以A是碳元素,B是地壳中含量最多的元素是氧元素,C的单质能从B的一种氢化物中置换出B的一种单质,是氟气与水反应生成氧气,所以C是氟,D是人体骨骼中的常见元素是钙,D的氢氧化物常用来检验A和B形成的一种化合物二氧化碳,F的原子序数比E大1,F是Ⅷ族元素中原子序数最小的一种元素是铁,所以E是锰,所以A是C、B是O、C是F、D是Ca、E是Mn、F是Fe,由此分析解答.
解答 解:(1)Mn的基态原子电子排布式为1s22s22p63s23p63d54s2;因为Mn2+的电子排布是1s22s22p63s23p63d5,成半充满状态,而Fe2+的电子排布为:1s22s22p63s23p63d6,不稳定,故答案为:1s22s22p63s23p63d54s2;Mn2+的电子排布成半充满状态,相对于Fe2+较为稳定;
(2)DA2是CaC2,电子式为: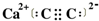 ,故答案为:
,故答案为: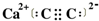 ;
;
(3)由化合物CaF2的晶胞结构可知,晶胞中含有实心球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,而含有空心球的数目为8,所以实心球是钙,空心球是氟,故晶胞的质量为4×$\frac{78}{{N}_{A}}$g,该离子化合物晶体的密度为a g/cm3,则晶胞的体积=$\frac{\frac{4×78}{{N}_{A}}g}{ag/c{m}^{3}}$=$\frac{78×4}{a{N}_{A}}$cm3,故答案为:Ca;$\frac{78×4}{a{N}_{A}}$;
(4)CO32-中C原子的价层电子对数=3+$\frac{4+2-2×3}{2}$=3,C原子孤对电子对数=$\frac{4+2-2×3}{2}$=0,CO32-为平面三角形,CO为中性配体,所以铁的化合价为0,故答案为:平面正三角形;0.
点评 本题综合查物质结构与性质,推断元素是解题的关键,涉及核外电子排布规律、分子结构、晶胞计算等,难度中等,(3)掌握均摊法进行晶胞的有关计算.

| A. | 鸡蛋和牛奶都含有大量蛋白质,可以在微波炉中加热牛奶和完整的鸡蛋 | |
| B. | 炒菜时油锅着火可以迅速盖上锅盖 | |
| C. | 天然气、沼气主要成分是甲烷,液化石油气的主要成分是丙烷、丁烷等 | |
| D. | 桌台抹布上有很多油污,放进沸水中并加少量纯碱煮几分钟会变得很干净 |
| A. | 标准状况下,22.4 L一氯甲烷和二氯甲烷的混合物中所含的氯原子数介于NA至2NA之间 | |
| B. | 0.1 mol Cu与足量热的浓硫酸反应生成SO2的体积约为22.4 L | |
| C. | 0.2 mol•L-1 Na2S溶液中含有的S2-数目小于0.2NA | |
| D. | 在反应Zn+2HNO3+NH4NO3═N2↑+3H2O+Zn(NO3)2中每溶解1 mol Zn,转移的电子数大于2NA |
| A. | 标准状况下,22.4 LSO3所含电子数约为40 NA | |
| B. | 0.5 mol NH4HSO4晶体中,含有H+数目约为0.5 NA | |
| C. | 92 g NO2、N2O4混合气体含有的N原子数为2NA | |
| D. | 1 mol Cl2作为氧化剂得到的电子数为NA |
(1)已知25℃时,几种常见弱酸的Ka如下表所示:
| 电解质 | H2C2O4 | CH3COOH | HCN | H2CO3 |
| 电离常数(mol•L-1) | K1=5.6×10-2 K2=5.4×10-3 | K1=1.7×10-5 | K2=6.2×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
②下列关于0.1mol•L?1NaHC2O4溶液的说法正确的是ad.
a.HC2O4-的电离程度大于水解程度,溶液显酸性
b.HC2O4-的水解程度大于电离程度程度,溶液显碱性
c.溶液中c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
d.溶液中c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
(2)在t℃时,MgC2O4在水中的沉淀溶解平衡曲线如图1所示.又知t℃时Mg(OH)2的Ksp=5.6×10-12,下列说法不正确的是BD.
A.在t℃时,MgC2O4的Ksp=8.1×10-5(mol•L-1).
B.在MgC2O4饱和溶液中加入Na2CO3固体,可使溶液由c点到b点
C.图中a点对应的是MgC2O4的不饱和溶液
D.在t℃时,MgC2O4 (s)+2OH-(aq)?Mg(OH)2(s)+C2O42-(aq)平衡常数K=Ksp[Mg(OH)2]/Ksp (MgC2O4)

(3)草酸亚铁晶体(FeC2O4•2H2O)是一种浅黄色固体,难溶于水,受热易分解.某化学兴趣小组设计实验验证草酸亚铁晶体热分解的产物,探究过程如图2:
①从环保角度考虑,该套实验装置的明显缺陷是缺少尾气处理装置.
②该兴趣小组进行上述实验时,从实验安全角度考虑,应先点燃A(填“A”或“E”)处的酒精灯.
③若实验过程中观察到B中白色无水CuSO4变成蓝色,C中澄清石灰水变浑浊,E中黑色粉末变红色.(补充实验现象),则可证明草酸亚铁晶体热分解的气体产物是H2O、CO和CO2.
④为探究草酸亚铁晶体分解的固体产物,兴趣小组同学准确称取3.60g草酸亚铁晶体(FeC2O4•2H2O),相对分子质量是180),充分加热,使其完全分解,冷却后称得剩余固体的质量为1.60g.若剩余固体只有一种铁的氧化物,通过计算确定该氧化物的化学式为Fe2O3.草酸亚铁晶体分解的化学方程式为FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3CO↑+CO2↑+2H2O.
| A. | 0.1mol•L-1CH3COONa溶液与0.1mol•L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 某温度下,KSP(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12;将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液,则先产生Ag2CrO4沉淀 | |
| C. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| D. | 在0.1 mol•L-1氨水中滴加0.1 mol•L-1盐酸,刚好完全中和时pH=a,则由水电离产生的c(H+)=10-amol•L-1 |
| A. | 原子序数:W>M>X>Y>Z | B. | 原子半径:Z>W>M>Y>X | ||
| C. | 离子半径:W2+>Z+>M->Y2- | D. | 最简单氢化物的热稳定性:M>Y>X |

| A. | 该栀子酯的分子式C10H11O2 | |
| B. | 1mol栀子酯水解需要消耗2mol NaOH | |
| C. | 栀子酯可以发生加成、取代和消去反应 | |
| D. | 栀子酯的一氯代物有六种 |