题目内容
4.设NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 标准状况下,22.4 LSO3所含电子数约为40 NA | |
| B. | 0.5 mol NH4HSO4晶体中,含有H+数目约为0.5 NA | |
| C. | 92 g NO2、N2O4混合气体含有的N原子数为2NA | |
| D. | 1 mol Cl2作为氧化剂得到的电子数为NA |
分析 A、标况下,三氧化硫为固体;
B、NH4HSO4晶体中只存在NH4+和HSO4-;
C、NO2、N2O4的最简式均为NO2;
D、氯气作为氧化剂时被还原为-1价.
解答 解:A、标况下,三氧化硫为固体,不能根据气体摩尔体积来计算其物质的量,故A错误;
B、NH4HSO4晶体中只存在NH4+和HSO4-,即NH4HSO4晶体中无氢离子,故B错误;
C、NO2、N2O4的最简式均为NO2,92g的混合气体中含有的NO2的物质的量n=$\frac{92g}{46g/mol}$=2mol,故含有2mol氮原子,故C正确;
D、氯气作为氧化剂时被还原为-1价,故1mol氯气得2mol电子,即2NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
15.实验室对茶叶中铁元素的检验,可经以下四个步骤完成:①将茶叶灼烧灰化;②茶叶灰用浓硝酸浸取并加蒸馏水稀释;③过滤得到滤液;④用KSCN溶液进行检验.下列说法中正确的是( )
| A. | 步骤①所用仪器包括蒸发皿、酒精灯、玻璃棒等 | |
| B. | 步骤②所用的浓硝酸应保存在带橡皮塞的棕色试剂瓶中 | |
| C. | 步骤③可以不做,改为将悬浊液静置一段时间 | |
| D. | 步骤④观察到溶液变红色,证明茶叶中含有Fe3+ |
16.化学与生活息息相关,下列说法错误的是( )
| A. | 乙烯可作为水果的催熟剂 | |
| B. | 地沟油经过处理,可用来制造肥皂 | |
| C. | 漂白粉长期暴露在空气中会变质失效 | |
| D. | 丙烷(C3H8)和乙醇(C2H5OH)均存在同分异构体 |
13.根据下列各图曲线表征的信息,得出的结论不正确的是( )
| A. | 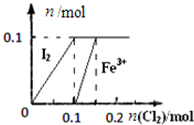 表示向100mL1 mol•L-1 FeI2溶液中逐渐通入Cl2,I2和Fe3+物质的量变化关系 | |
| B. | 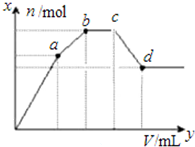 表示向100mL 0.1 mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol•L-1 Ba(OH)2溶液,沉淀物质的量变化的关系 | |
| C. |  表示在不同温度下,水溶液中c(H+)与c(OH-)变化关系 | |
| D. |  得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右 |
14.下列说法正确的是( )
| A. | 室温下,0.001 mol•L-1的醋酸中由水电离的c(H+)=10-11mol•L-1 | |
| B. | Na2CO3溶液中存在c(Na+)+c(H+)═c(OH-)+a c(X)+b c(Y),若X为HCO3-,则b=2 | |
| C. | 某温度下,浓度均为0.01mol•L-1的盐酸和氢氧化钠溶液的pH分别为2和12 | |
| D. | 向0.1mol•L-1氯化铵溶液滴加几滴浓盐酸,c(NH4+)减小,PH增大 |

 As、N、0等非金属元素的化合物在工业生产中有重要的应用.
As、N、0等非金属元素的化合物在工业生产中有重要的应用.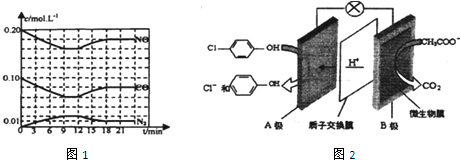
 )的酸性废水,可利用微生物电池法除去,其原理如图2所示
)的酸性废水,可利用微生物电池法除去,其原理如图2所示 已知A、B、C、D、E、F都是元素周期表中前36号的元素,它们的原子序数依次增大.A的一种单质是自然界硬度最大的物质,B是地壳中含量最多的元素,C的单质能从B的一种氢化物中置换出B的一种单质,D是人体骨骼中的常见元素,D的氢氧化物常用来检验A和B形成的一种化合物,F的原子序数比E大1,F是Ⅷ族元素中原子序数最小的一种元素.
已知A、B、C、D、E、F都是元素周期表中前36号的元素,它们的原子序数依次增大.A的一种单质是自然界硬度最大的物质,B是地壳中含量最多的元素,C的单质能从B的一种氢化物中置换出B的一种单质,D是人体骨骼中的常见元素,D的氢氧化物常用来检验A和B形成的一种化合物,F的原子序数比E大1,F是Ⅷ族元素中原子序数最小的一种元素.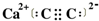 .
.