题目内容
20.下列关于厨房中的化学不符合科学道理的是( )| A. | 鸡蛋和牛奶都含有大量蛋白质,可以在微波炉中加热牛奶和完整的鸡蛋 | |
| B. | 炒菜时油锅着火可以迅速盖上锅盖 | |
| C. | 天然气、沼气主要成分是甲烷,液化石油气的主要成分是丙烷、丁烷等 | |
| D. | 桌台抹布上有很多油污,放进沸水中并加少量纯碱煮几分钟会变得很干净 |
分析 A、蛋白质受热会发生一定程度的膨胀;
B、油锅着火后迅速盖上锅盖可将可燃物隔绝空气;
C、天然气和沼气的主要成分是甲烷,液化石油气的主要成分是C3-C4的烷烃类;
D、纯碱水解呈碱性.
解答 解:A、蛋白质受热会发生一定程度的膨胀,故完整的鸡蛋在用微波炉里加热时会发生爆炸,故A错误;
B、油锅着火后迅速盖上锅盖可将可燃物隔绝空气,起到灭火的作用,故B正确;
C、天然气和沼气的主要成分是甲烷,液化石油气的主要成分是C3-C4的烷烃类,即丙烷和丁烷,故C正确;
D、纯碱水解生成NaOH,能使油脂水解,从而达到去油污的目的,故D正确.
故选A.
点评 本题考查了化学在实际生活中的应用,主要生活经验的积累,难度不大.

练习册系列答案
相关题目
15.实验室对茶叶中铁元素的检验,可经以下四个步骤完成:①将茶叶灼烧灰化;②茶叶灰用浓硝酸浸取并加蒸馏水稀释;③过滤得到滤液;④用KSCN溶液进行检验.下列说法中正确的是( )
| A. | 步骤①所用仪器包括蒸发皿、酒精灯、玻璃棒等 | |
| B. | 步骤②所用的浓硝酸应保存在带橡皮塞的棕色试剂瓶中 | |
| C. | 步骤③可以不做,改为将悬浊液静置一段时间 | |
| D. | 步骤④观察到溶液变红色,证明茶叶中含有Fe3+ |
10.25℃时,弱酸的电离平衡常数如下表,下列叙述不正确的是( )
| 弱酸 | CH3COOH | HCN | H2CO3 |
| K | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 等体积、等物质的量浓度的CH3COOH溶液和Na2CO3溶液反应后的溶液呈碱性 | |
| B. | a mol/LHCN溶液与bmol/LNaOH溶液等体积混合,所得溶液c(Na+)>c(CN- ),则a可能等于b | |
| C. | 相同温度时,等物质的量浓度三种溶液的PH关系:NaCN>Na2CO3>CH3COONa | |
| D. | 向NaCN溶液中通入少量的CO2离子方程式为:CN-+H2O+CO2=HCN+HCO3- |
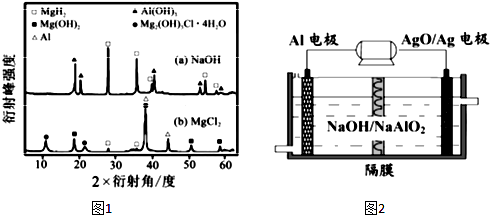
 煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:
煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题: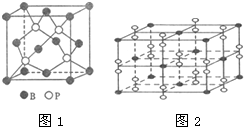 As、N、0等非金属元素的化合物在工业生产中有重要的应用.
As、N、0等非金属元素的化合物在工业生产中有重要的应用. 已知A、B、C、D、E、F都是元素周期表中前36号的元素,它们的原子序数依次增大.A的一种单质是自然界硬度最大的物质,B是地壳中含量最多的元素,C的单质能从B的一种氢化物中置换出B的一种单质,D是人体骨骼中的常见元素,D的氢氧化物常用来检验A和B形成的一种化合物,F的原子序数比E大1,F是Ⅷ族元素中原子序数最小的一种元素.
已知A、B、C、D、E、F都是元素周期表中前36号的元素,它们的原子序数依次增大.A的一种单质是自然界硬度最大的物质,B是地壳中含量最多的元素,C的单质能从B的一种氢化物中置换出B的一种单质,D是人体骨骼中的常见元素,D的氢氧化物常用来检验A和B形成的一种化合物,F的原子序数比E大1,F是Ⅷ族元素中原子序数最小的一种元素.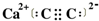 .
.