题目内容
3.把a L含碳酸铵、氯化铵的溶液分成两等份,一份需用b mol烧碱刚好把氨全部赶出,另一份与氯化钡溶液反应时,消耗c mol氯化钡,由此可知原溶液中Cl-的物质的量浓度是(单位:mol•L-1)( )| A. | $\frac{b-2c}{a}$ | B. | $\frac{b-2c}{2a}$ | C. | $\frac{2b-c}{a}$ | D. | $\frac{2b-4c}{a}$ |
分析 根据NH4++OH-═NH3+H2O来计算铵根离子的物质的量,利用Ba2++SO42-═BaSO4↓来计算硫酸根离子的物质的量,再根据溶液不显电性来计算原溶液中N03-的物质的量浓度.
解答 解:设每份中NH4+的物质的量为x,SO42-的物质的量为y,则
NH4++OH-═NH3+H2O
1 1
x b
则:x=b,则每份中NH4+的物质的量为bmol,
Ba2++SO42-═BaSO4↓
1 1
c y
则:y=c,则每份中SO42-的物质的量为cmol,
由aL含硫酸铵和硝酸铵的混合液分成两等份,
则原溶液中NH4+的物质的量浓度为:$\frac{2b}{a}$mol/L,
原溶液中SO42-的物质的量浓度为:$\frac{2c}{a}$mol/L,
设原溶液中N03-的物质的量浓度为z,
由溶液不显电性,根据电荷守恒可知,$\frac{2b}{a}$mol/L×1=$\frac{2c}{a}$mol/L×2+z×1,
解得z=$\frac{2b-4c}{a}$mol/L,
故选D.
点评 本题考查了混合物的计算、物质的量浓度的计算,题目难度中等,明确发生反应原理为解答关键,注意掌握物质的量浓度的计算方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
13.下列图象中的曲线正确的是( )
| A. | 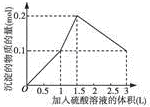 图A表示在1L含0.1mol NaAlO2和0.1mol Ba(OH)2的混合溶液中,逐滴加入浓度为0.11mol•L-1H2SO4溶液,产生沉淀的物质的量与加入硫酸溶液体积的图象 | |
| B. | 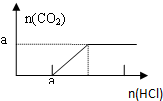 图B表示在分别含amol的Na2CO3和NaOH的混合溶液中逐滴滴加稀盐酸,产生气体 与加入盐酸体积的图象 | |
| C. | 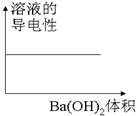 图C表示向100mL 0.1mol/L H2SO4溶液中,逐滴加入0.1mol/L Ba(OH)2溶液至过量, 溶液的导电性与加入 Ba(OH)2溶液体积的图象 | |
| D. | 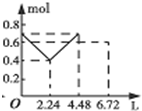 图D表示在往含0.2mol NaOH和0.1mol Ba(OH)2的溶液中持续稳定地通入CO2气体, 溶液中离子数目和通入CO2气体体积的图象(气体的溶解忽略不计) |
14.下列关于晶体的说法正确的是( )
| A. | 熔化二氧化硅和金刚石时所克服的粒子间的作用力类型同种 | |
| B. | 原子晶体的熔点一定比金属的高 | |
| C. | 构成分子晶体的微粒一定含有共价键 | |
| D. | 晶体中只要有阳离子就一定有阴离子 |
18.下列各组物质的晶体中,晶体类型相同,化学键类型也完全相同的是( )
| A. | CO2和SiO2 | B. | CCl4和Fe | C. | CaCl2和HCl | D. | SO3和SO2 |
15.对下面有机物的叙述不正确的是( )
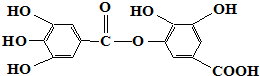

| A. | 常温下可以和Na2CO3溶液反应生成CO2气体 | |
| B. | 在碱性条件下水解,0.5mol该物质完全反应可以消耗4mol NaOH | |
| C. | 与稀H2SO4共热生成两种不同的有机物 | |
| D. | 该物质的化学式为C14H10O9 |
4.相同物质的量的 Na+、OH-、F- 离子具有相同的( )
| A. | 质量 | B. | 质子数 | C. | 电子数 | D. | 中子数 |
5.下列仪器中,能在酒精灯火焰上直接加热的玻璃仪器是( )
| A. | 试管 | B. | 蒸发皿 | C. | 烧杯 | D. | 蒸馏烧瓶 |
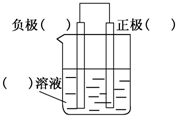 化学反应与能量有着密不可分的关系,回答下列问题.
化学反应与能量有着密不可分的关系,回答下列问题.