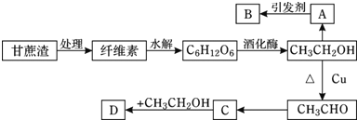
题目内容
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
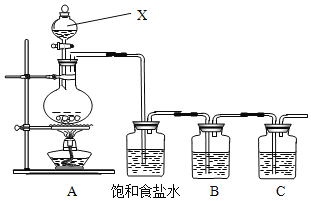
(1)请写出A装置中发生反应的化学方程式___。
(2)饱和食盐水的作用是_____。
(3)装置B中盛放的试剂是___(选填下列所给试剂的编号),反应离子方程式是__。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)装置C中盛放的是烧碱溶液,目的是:______________________
(5)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强_____(填编号)
①HCl比H2S稳定 ②HClO氧化性比H2SO4强 ③HClO4酸性比H2SO4强 ④HCl酸性比H2S强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子 ⑥铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS
(6)此装置有多种用途,若用此装置验证氯元素的非金属性比碘元素的强,需要在B装置中加入KI溶液,通入一段时间气体后向B中加入少量CCl4,振荡。能够证明氯元素的非金属性比碘元素的强的实验现象是_____
【答案】![]() 除去Cl2中的HCl气体 A S2-+ Cl2 ═ 2Cl- + S↓ 尾气处理 ①③⑥ 溶液分层,下层为紫红色
除去Cl2中的HCl气体 A S2-+ Cl2 ═ 2Cl- + S↓ 尾气处理 ①③⑥ 溶液分层,下层为紫红色
【解析】
(1)为验证氯元素的非金属性比硫元素的非金属性强,需要用氯气置换出硫,则必须用装置A制备氯气,装置A中浓盐酸与二氧化锰加热制取氯气,该反应的化学方程式为: ![]() ,故答案为:
,故答案为:![]() ;
;
(2)由于用浓盐酸制取氯气,且需要加热,即实验过程中会挥发出HCl气体,氯气在饱和食盐水在的溶解度较小,利用饱和食盐水除去Cl2中的HCl气体,故答案为:除去Cl2中的HCl气体;
(3) 要在B中发生氯气置换出硫的反应,在给定试剂中只能选取Na2S溶液,故选A,发生的是置换反应,发生反应的离子方程式为S2-+ Cl2 ═ 2Cl- + S↓,故答案为:A ; S2-+ Cl2 ═ 2Cl- + S↓;
(4)由于氯气有毒,不能直接排放到大气中,故装置C中盛放的是烧碱溶液,是吸收氯气,进行尾气处理,故答案为:吸收氯气,尾气处理;
(5)①简单氢化物的稳定性越强,非金属性越强,HCl比H2S稳定,说明非金属性Cl>S,故①正确;
②非金属性强弱与含氧酸的氧化性强弱没有关系,故②错误;
③最高价含氧酸HClO4酸性比H2SO4强,能够证明非金属性Cl>S,故③正确;
④HCl不是最高价含氧酸,无法比较二者非金属性,故④错误;
⑤不能根据最外层电子数多判断非金属性强弱,故⑤错误;
⑥铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS,说明氯气的氧化性大于S,可证明非金属性Cl>S,故⑥正确;
故答案为:①③⑥;
(6)在B装置中加入KI溶液,发生反应Cl2+2I-=I2+2Cl-,氯气氧化碘离子为碘单质,充分反应后,加入CCl4用力振荡,碘单质易溶于四氯化碳中,观察到的现象为:在下层四氯化碳中呈紫红色,可证明氯元素的非金属性比碘元素的强,故答案为:溶液分层,下层为紫红色。
![]()