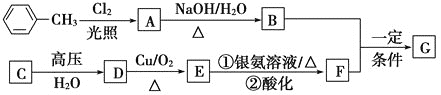
题目内容
【题目】下列化学用语对事实的解释不正确的是
A.NaHS水溶液显碱性:HS-+H2OS2-+H3O+
B.苯酚能溶于Na2CO3溶液:C6H5OH+CO32-=C6H5O-+HCO3-
C.三元催化剂净化汽车尾气中的NO和CO:2NO+2CO![]() 2CO2+N2
2CO2+N2
D.铜矿淋溶液(CuSO4)遇方铅矿(PbS)发生沉积:Cu2++SO42-+PbS=CuS+PbSO4
【答案】A
【解析】
A.NaHS水溶液显碱性:HS-+H2OH2S+OH-,故A错误;
B.酸性:H2CO3>C6H5OH>HCO3-,苯酚能溶于Na2CO3溶液:C6H5OH+CO32-=C6H5O-+HCO3-,故B正确;
C.三元催化剂净化汽车尾气中的NO和CO:2NO+2CO![]() 2CO2+N2,故C正确;
2CO2+N2,故C正确;
D.铜矿淋溶液(CuSO4)遇方铅矿(PbS)发生沉积:Cu2++SO42-+PbS=CuS+PbSO4,CuS更难溶,故D正确;
故选A。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】有关短周期主族元素A、B、C、D、E、F的信息如下:
有关信息 | |
A | 其中一种核素的中子数为0 |
B | 最高价氧化物对应的水化物按1:1完全电离出电子数相等的阴、阳离子 |
C | 在地壳中的含量为第三位 |
D | 其单质在O2中燃烧,发出明亮的蓝紫色火焰 |
E | 是形成化合物种类最多的元素 |
F | 其单质常用做保护气体 |
(1)C元素是________(填元素名称),D在元素周期表中的位置是________。
(2)工业上得到C的单质常采用惰性电极电解熔融______(填化学式)的方法,C的单质可以和B的最高价氧化物的水化物发生反应,写出该反应的离子方程式:______。C形成某种化合物LiCA4既是金属储氢材料又是有机合成中的常用试剂,遇水能释放出A2,那么LiCA4中A元素的化合价为_________。
(3)在一定条件下,A与F可形成一种易溶于水的液体F2A4,其电子式为________;该物质可由NaClO与FA3反应制得,写出反应的化学方程式:_______,每生成1mol F2A4转移电子数为________。
(4)写出一个能证明E和F非金属性强弱的化学方程式________。
(5)化合物W由A、D、E、F四种元素组成。向W溶液中滴入FeCl3溶液,溶液变血红色;另取一份W溶液加入强碱溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,W的化学式为________。
(6)F的简单氢化物的沸点比它的同族相邻周期元素氢化物沸点高,理由是__________。
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:(NA为阿伏加德罗常数的值),请用化学用语回答下列
元素 | 相关信息 |
A | 基态原子的价电子排布式为nsnnpn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
(1)写出D元素在周期表的位置___,基态E2+价电子的排布图为___,B元素能量最高的电子其轨道呈__形。
(2)A与C形成的最高价化合物,中心原子轨道杂化类型为__。
(3)A、B、C三种基态原子的第一电离能由大到小的顺序为___,B、C、D简单离子的半径由大到小的顺序为___。
(4)写出C的核外有18个电子的氢化物的电子式___。
(5)E可用做某些反应的催化剂,CO易导致E失去催化活性:E+5CO=E(CO)5,E(CO)5熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为___。
(6)已知沸点:B2H4>A2H6,主要原因为________。
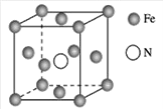
(7)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为___
【题目】位于前四周期的6种主族元素A、B、C、D、E、F原子序数依次增大,其中B、D同主族, D、E同周期。A、B、C在周期表中相邻,且三种元素的原子最外层电子数之和为18。F是其所在周期中最活泼的金属元素。根据推断回答下列问题:
(1)A在周期表中的位置_____;写出A单质的电子式________。
(2)用“>”或“<”填空:
离子半径 | 非金属性 | 酸性 | 氢化物的稳定性 |
F+_D2— | A_B | D的最高价氧化物的水化物___E的最高价氧化物的水化物 | C的氢化物__E的氢化物 |
(3)—定条件,在水溶液中1molE-、![]() (x=1,2,3,4)的能量(KJ)相对大小如图所示。
(x=1,2,3,4)的能量(KJ)相对大小如图所示。
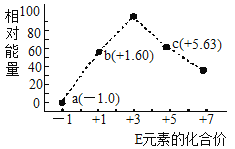
①c点对应的微粒是_______(填离子符号)。
②b→a+c反应的离子方程式为________,该反应是______反应(填“吸热”或“放热”)。