题目内容
12. 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH3CH=CH2+CO+H2$\stackrel{一定条件}{→}$CH3CH2CH2CHO$→_{Ni△}^{H_{2}}$ CH3CH2CH2CH2OH;
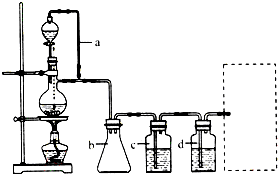
CO的制备原理:HCOOH$→_{△}^{浓H_{2}SO_{4}}$CO↑+H2O,并设计出原料气的制备装置(如图).
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式:Zn+2HCl=ZnCl2+H2↑,(CH3)2CHOH $\stackrel{催化剂}{→}$CH2=CHCH3↑+H2O.
(2)用以上装置制备干燥纯净的CO,装置中a和b的作用分别是恒压,防倒吸.c和d中盛装的试剂分别是NaOH溶液,浓H2SO4.
(3)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品.为纯化1-丁醇,该小组查阅文献得知:①R-CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;②沸点:乙醚34℃,1-丁醇 118℃,并设计出如下提纯路线:
粗品$→_{操作1}^{试剂1}$滤液 $→_{操作2分液}^{乙醇}$有机层 $→_{过滤}^{干燥剂}$ 1-丁醇、乙醚$\stackrel{操作3}{→}$ 纯品
试剂1为饱和NaHSO3溶液,操作1为过滤,操作2为萃取,操作3为蒸馏.
分析 (1)制备氢气选用锌粒和稀盐酸;制备丙烯选用2-丙醇和浓硫酸;
(2)在题给装置中,a的作用保持分液漏斗和烧瓶内的气压相等,以保证分液漏斗内的液体能顺利加入烧瓶中;b主要是起安全瓶的作用,以防止倒吸;c为除去CO中的酸性气体,选用NaOH溶液,d为除去CO中的H2O,试剂选用浓硫酸;
(3)饱和NaHSO3溶液形成沉淀,然后通过过滤即可除去;1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开;
解答 解:(1)氢气可用活泼金属锌与非氧化性酸盐酸通过置换反应制备,氧化性酸如硝酸和浓硫酸与锌反应不能产生氢气,方程式为Zn+2HCl=ZnCl2+H2↑;2-丙醇通过消去反应即到达丙烯,方程式为:(CH3)2CHOH $\stackrel{催化剂}{→}$CH2=CHCH3↑+H2O,
故答案为:Zn+2HCl=ZnCl2+H2↑、(CH3)2CHOH $\stackrel{催化剂}{→}$CH2=CHCH3↑+H2O;
(2)甲酸在浓硫酸的作用下通过加热脱水即生成CO,由于甲酸易挥发,产生的CO中必然会混有甲酸,所以在收集之前需要除去甲酸,可以利用NaOH溶液吸收甲酸.又因为甲酸易溶于水,所以必需防止液体倒流,即b的作用是防止倒吸,最后通过浓硫酸干燥CO.为了使产生的气体能顺利的从发生装置中排出,就必需保持压强一致,因此a的作用是保持恒压,
故答案为:恒压;防倒吸; NaOH溶液;浓H2SO4;
(3)粗品中含有正丁醛,根据所给的信息利用饱和NaHSO3溶液形成沉淀,然后通过过滤即可除去;由于饱和NaHSO3溶液是过量的,所以加入乙醚的目的是萃取溶液中的1-丁醇.因为1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开.
故答案为:饱和NaHSO3溶液;过滤;萃取;蒸馏.
点评 本题考查有机物合成方案的设计,题目难度较大,综合性较强,答题时注意把握物质的分离、提纯方法,把握物质的性质的异同是解答该题的关键.

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案(2)对于反应2SO2+O2?2SO3 其它条件不变,只改变一个反应条件,将生成SO3的反应速率的变化填入表中空格里.(填字母 A.增大 B.减小 C.不变)
| 改变条件 | 速率变化 |
| 降低温度 | |
| 增大O2的浓度 | |
| 使用V2O5做催化剂 | |
| 压缩气体 |
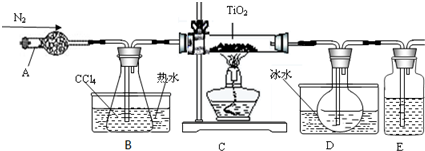
有关性质如下表
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(2)反应结束前依次进行如下操作:①停止通氮气 ②熄灭酒精灯 ③冷却至室温.正确的顺序为②③①(填序号).
(3)欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(4)使用冰水混合物的目的是冷却TiCl4气体.
(5)TiCl4 遇到湿空气发生强烈的水解,其中一种物质是H2TiO3,试写出该水解反应方程式TiCl4+3H2O═H2TiO3↓+4HCl.
(6)实验室用含量为97%的TiO210克,用上述方法制备TiCl4,最终得到19.8克的产品,则TiO2的转化率为85.95%.
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2+H2O,CH2=CH2+Br2→BrCH2CH2Br
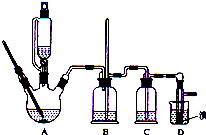
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据如表:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母,下同)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体;
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用b洗涤除去;
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
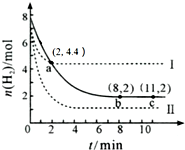
| A. | 该温度下,a点时,3 v正(CO2)=v正(H2) | |
| B. | 曲线Ⅱ对应的条件改变可能是充入氦气 | |
| C. | 曲线Ⅰ对应的条件改变可能是降低温度 | |
| D. | 从反应开始至a点,v (CO2)=0.6 mol•L-1•min-1 |
| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
Ⅱ.该反应为吸热(填“吸热”或“放热”)反应.
Ⅲ.某温度下,反应体系中各物质的平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的反应温度为700℃.
Ⅳ.830℃时,向该容器中加入1molCO2与1molH2开始反应,达到平衡时,混合气体中CO2的体积分数是25%.
Ⅴ.保持温度不变,若往IV的平衡体系中再通入2molCO2与2molH2,则再达新平衡时,H2的转化率为50%.
| A. | 氯气与水反应:Cl2+H2O=2H++Cl-+ClO- | |
| B. | 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-$\frac{\underline{\;△\;}}{\;}$Mn2++Cl2↑+2H2O | |
| C. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O | |
| D. | Fe3O4与稀HNO3反应:Fe3O4+8H+=Fe2++2Fe3++4H2O |