题目内容
11.在 2L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.4kJ/mol起始反应时NO和CO为4mol,10s达到化学平衡,测得N2为1mol.下列说法中正确的是( )
| A. | 反应前5 s内,用NO表示的平均反应速率为0.1 mol•L-1•S-1 | |
| B. | 达到平衡后,CO2的浓度与CO的浓度不同 | |
| C. | 当v正(CO)=2v逆(N2)时反应达到平衡 | |
| D. | 达到平衡后,升高温度,正反应速率将减小,逆反应速率将增大 |
分析 A、根据v=$\frac{△c}{△t}$计算前10内v(N2),再利用速率之比等于化学计量数之比计算前10s内v(NO),前5s反应物的浓度更大,反应速率更快,故前5s的平均速率大于前10s的平均速率;
B、依据题意计算即可;
C、可逆反应达平衡时,用不同物质表示正、逆速率之比等于化学计量数之比;
D、升高温度正逆反应速率都增大.
解答 解:A、前10秒钟内,v(N2)=$\frac{\frac{1mol}{2L}}{10s}$=0.05mol/(L•s),速率之比等于化学计量数之比,故前10s内v(NO)=2v(N2)=2×0.05mol/(L•s)=0.1mol/(L•s),前5s反应物的浓度更大,反应速率更快,故前5s的平均速率大于前10s的平均速率,即前5秒钟内,用NO表示的平均反应速率大于0.1mol/(L•s),故A错误;
B、达到平衡后,CO2的浓度为$\frac{2mol}{2L}$=1mol/L,CO的浓度为:$\frac{4mol-2mol}{2L}$=1mol/L,两者相等,故B错误;
C、可逆反应达平衡时,用不同物质表示正、逆速率之比等于化学计量数之比,v正(CO)=2v逆(N2)时正、逆速率之比等于化学计量数之比,说明反应到达平衡状态,故C正确;
D、升高温度正、逆反应速率都增大,故D错误,故选C.
点评 本题考查化学反应速率计算与影响因素、化学平衡状态判定、影响化学平衡的因素等,难度中等,注意A中,开始反应物的浓度最大,反应速率最快.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
1.为使Fe2+、Fe3+、Zn2+较完全地形成氢氧化物沉淀,溶液的酸碱度分别为pH 7.7、pH 4.5、pH 6.6.某硫酸锌酸性溶液中含有少量Fe2+,Fe3+杂质离子,为除去这些离子制得纯净的ZnSO4,应加入的试剂是( )
| A. | NaOH溶液 | B. | 氨水 | C. | KMnO4,ZnCO3 | D. | H2O2,ZnO |
19.下列说法正确的是( )
| A. | 原子核都是由质子和中子构成 | |
| B. | KClO3和SO3溶于水后能导电,故KClO3和SO3是电解质 | |
| C. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| D. | 过量的铜与浓硝酸反应有NO生成 |
6.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,不正确的是( )
| A. | 加热饱和三氯化铁溶液制备氢氧化铁胶体:Fe3++3H2O$\stackrel{△}{?}$Fe(OH)3(胶体)+3H+ | |
| B. | 磷酸二氢根电离的离子方程式:H2PO4-+H2O?H3O++HPO42- | |
| C. | 少量碳酸氢钙溶液与氢氧化钠溶液混合的离子方程式Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | |
| D. | 在0.5mol•L-1的K2Cr2O7溶液中存在如下平衡:CrO72-+H2O?2CrO42-+2H+,其平衡常数K的表达式为K=$\frac{{c}^{2}(Cr{O}_{4}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{O}_{7}^{2-})}$ |
16.关于沉淀溶解平衡和溶度积常数,下列说法不正确的是( )
| A. | Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 | |
| B. | 将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp[CaSO4] | |
| C. | 已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,该温度下反应Fe(OH)3+3H+?Fe3++3H2O的平衡常数K=4.0×104 | |
| D. | 已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,在MgCl2溶液中加入氨水调混合液的pH=11,产生沉淀,则此时溶液中的c(Mg2+)=1.8×10-5mol•L-1 |
3.下列说法不正确的是( )
| A. | 126C、136C、146C为碳元素的三种核素.元素周期表中碳的相对原子质量为12.01,说明自然界中的碳主要以126C的核素形式存在 | |
| B. | 汽车尾气催化转化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,加快该反应的速率,却不能提高该反应的平衡转化率 | |
| C. | 人们通常用标准燃烧热或热值来衡量燃料燃烧放出热量的大小,某物质的热值越高则其标准燃烧热越大 | |
| D. | 绿色荧光蛋白在研究癌症发病机制的过程中应用突出,但其在酸性或碱性条件下可能会失去发光功能 |
20.用灼烧法证明海带中含有碘元素,各步骤选用的实验用品不必都用到( )
| 实验步骤 | 实验用品 | |
| A | 步骤1:将海带灼烧灰化 |  |
| B | 步骤2:将海带灰溶解、过滤 | 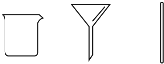 |
| C | 步骤3:氧化滤液中的I- | 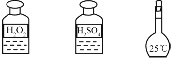 |
| D | 步骤4:检验碘元素 |  |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
1.下列有关化学用语表示正确的是( )
| A. | 过氧化钙(CaO2)的电子式: | |
| B. | 816O2-离子的结构示意图: | |
| C. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| D. | 葡萄糖的结构简式:C6H12O6 |