题目内容
2.现有短周期X、Y、Z三种元素,其中X是形成化合物最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子.回答下列问题:
(1)写出元素名称:X氢、Y碳.
(2)Y2X2分子中Y原子轨道的杂化类型为sp杂化,1mol Y2X2含有σ键的数目为3NA.
(3)化合物ZX3中Z原子轨道的杂化类型为sp3杂化
(4)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是N2O.
分析 原子序数小于18的X、Y、Z三种元素,其中X是形成化合物最多的元素,则X是氢元素;Y原子基态时最外层电子数是其内层电子数的2倍,原子最外层电子数不超过8个,所以其内层为K层,则Y是C元素;Z原子基态时2p原子轨道上有3个未成对的电子,则Z是N元素,据此解答即可.
解答 解:依据分析可知:X为氢、Y为碳、Z为氮,
(1)X为氢、Y为碳,故答案为:氢;碳;
(2)C2H2分子中每个C原子含有2个σ键,所以C轨道的杂化类型为sp杂化,一个乙炔分子中含有3个σ键,则1mol C2H2含有σ键的数目为3NA,故答案为:sp杂化;3NA;
(3)氨气中价层电子对个数=3+$\frac{1}{2}$(5-3×1)=4且含有1个孤电子对,所以N原子采用sp3杂化,故答案为:sp3杂化;
(4)元素C的一种氧化物与元素N的一种氧化物互为等电子体,CO2和N2O互为等电子体,所以元素Z的这种氧化物的分子式是N2O,故答案为:N2O.
点评 本题考查了元素位置结构性质的相互关系及应用,涉及氢键、原子杂化方式的判断等知识点,这些知识点都是考试热点,灵活运用基本知识来分析解答,题目难度不大.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
13.150℃时,将1L混合烃与9L氧气混合,在密闭容器内充分燃烧,当恢复至150℃,体积恒定时,容器内压强增大8%,则该混合烃的组成是( )
| A. | 甲烷与乙烷体积比是1:4 | B. | 丙炔与乙炔体积比是1:4 | ||
| C. | 乙烯与丁烷体积比是1:4 | D. | 乙烯与丁烯体积比是1:4 |
10.下列关于元素的说法正确的是( )
| A. | 元素周期表中元素种类最多的周期是第6周期 | |
| B. | 第IA族元素均为碱金属元素 | |
| C. | 原子最外层电子数为2的元素一定位于第ⅡA族 | |
| D. | 元素周期表中元素种类最多的族是第Ⅷ族 |
7.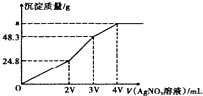 某混合溶液中含有溶质为NaCl、KI和Na2S各0.1mol,往该溶液在加入一定浓度的AgNO3溶液,产生沉淀的质量随加入AgNO3溶液的体积变化如图所示,则下列说法中不正确的是( )
某混合溶液中含有溶质为NaCl、KI和Na2S各0.1mol,往该溶液在加入一定浓度的AgNO3溶液,产生沉淀的质量随加入AgNO3溶液的体积变化如图所示,则下列说法中不正确的是( )
 某混合溶液中含有溶质为NaCl、KI和Na2S各0.1mol,往该溶液在加入一定浓度的AgNO3溶液,产生沉淀的质量随加入AgNO3溶液的体积变化如图所示,则下列说法中不正确的是( )
某混合溶液中含有溶质为NaCl、KI和Na2S各0.1mol,往该溶液在加入一定浓度的AgNO3溶液,产生沉淀的质量随加入AgNO3溶液的体积变化如图所示,则下列说法中不正确的是( )| A. | 所加AgNO3溶液的物质的量浓度为$\frac{0.1}{V}mol•{L}^{-1}$ | |
| B. | a的数值为62.65 | |
| C. | 常温下,AgCl,AgI,AgS在水中溶解能力依次减小 | |
| D. | 在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成 |
14.若要使2mol CH4完全和Cl2发生取代反应,且生成的四种氯代物的物质的量相同,则所需Cl2的物质的量为( )
| A. | 5mol | B. | 4mol | C. | 3mol | D. | 2mol |
11.在 2L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.4kJ/mol
起始反应时NO和CO为4mol,10s达到化学平衡,测得N2为1mol.下列说法中正确的是( )
起始反应时NO和CO为4mol,10s达到化学平衡,测得N2为1mol.下列说法中正确的是( )
| A. | 反应前5 s内,用NO表示的平均反应速率为0.1 mol•L-1•S-1 | |
| B. | 达到平衡后,CO2的浓度与CO的浓度不同 | |
| C. | 当v正(CO)=2v逆(N2)时反应达到平衡 | |
| D. | 达到平衡后,升高温度,正反应速率将减小,逆反应速率将增大 |
12.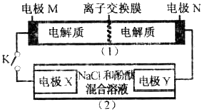 如图装置(1)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充、放电的化学方程式为2K2S2+KI3$?_{放电}^{充电}$K2S4+3KI.
如图装置(1)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充、放电的化学方程式为2K2S2+KI3$?_{放电}^{充电}$K2S4+3KI.
装置(2)为电解池的示意图.当闭合开关K时,X附近溶液先变红,下列说法正确的是( )
 如图装置(1)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充、放电的化学方程式为2K2S2+KI3$?_{放电}^{充电}$K2S4+3KI.
如图装置(1)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充、放电的化学方程式为2K2S2+KI3$?_{放电}^{充电}$K2S4+3KI.装置(2)为电解池的示意图.当闭合开关K时,X附近溶液先变红,下列说法正确的是( )
| A. | K+从右到左通过离子交换膜 | |
| B. | 电极M的反应式:I3-+2e-=3I- | |
| C. | 电极X的反应式:4OH--4e-═O2↑+2H2O | |
| D. | 当电极Y有0.2mole-转移时,产生0.1molCl2 |
