题目内容
6.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,不正确的是( )| A. | 加热饱和三氯化铁溶液制备氢氧化铁胶体:Fe3++3H2O$\stackrel{△}{?}$Fe(OH)3(胶体)+3H+ | |
| B. | 磷酸二氢根电离的离子方程式:H2PO4-+H2O?H3O++HPO42- | |
| C. | 少量碳酸氢钙溶液与氢氧化钠溶液混合的离子方程式Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | |
| D. | 在0.5mol•L-1的K2Cr2O7溶液中存在如下平衡:CrO72-+H2O?2CrO42-+2H+,其平衡常数K的表达式为K=$\frac{{c}^{2}(Cr{O}_{4}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{O}_{7}^{2-})}$ |
分析 A.氢氧化铁胶体的制备中,反应是不可逆的;
B.磷酸二氢根离子的电离是可逆的;
C.氢氧化钠过量,反应生成碳酸钙沉淀、碳酸钠和水;
D.根据化学平衡常数的概念及表达式进行判断.
解答 解:A.加热饱和三氯化铁溶液制备氢氧化铁胶体的离子反应为Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+,故A错误;
B.磷酸二氢根离子在溶液中电离出硫酸氢根了离子和氢离子,其电离的离子方程式为:H2PO4-+H2O?H3O++HPO42-,故B正确;
C.少量碳酸氢钙溶液与氢氧化钠溶液混合,离子方程式按照碳酸氢钙的化学式组成书写,反应的离子方程式:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-,故C正确;
D.0.5mol•L-1的K2Cr2O7溶液中存在如下平衡:CrO72-+H2O?2CrO42-+2H+,根据平衡常数的概念可知,其平衡常数K的表达式为:K=$\frac{{c}^{2}(Cr{O}_{4}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{O}_{7}^{2-})}$,故D正确;
故选A.
点评 本题考查了离子方程式的正误判断、化学平衡常数表达式的书写,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法及化学平衡常数的概念、书写原则,试题培养了学生的规范答题的能力.

练习册系列答案
相关题目
14.若要使2mol CH4完全和Cl2发生取代反应,且生成的四种氯代物的物质的量相同,则所需Cl2的物质的量为( )
| A. | 5mol | B. | 4mol | C. | 3mol | D. | 2mol |
1.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | KI溶液中:Ca2+、Na+、ClO-、Cl- | |
| B. | 滴入酚酞试液显红色的溶液中:Al3+、K+、AlO2-、SO42- | |
| C. | c(H+)=10-12mol•L-1的溶液中:K+、Na+、NO3-、Cl- | |
| D. | 加入铝粉产生氢气的溶液中:Na+、Mg2+、HCO3-、SO42- |
11.在 2L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.4kJ/mol
起始反应时NO和CO为4mol,10s达到化学平衡,测得N2为1mol.下列说法中正确的是( )
起始反应时NO和CO为4mol,10s达到化学平衡,测得N2为1mol.下列说法中正确的是( )
| A. | 反应前5 s内,用NO表示的平均反应速率为0.1 mol•L-1•S-1 | |
| B. | 达到平衡后,CO2的浓度与CO的浓度不同 | |
| C. | 当v正(CO)=2v逆(N2)时反应达到平衡 | |
| D. | 达到平衡后,升高温度,正反应速率将减小,逆反应速率将增大 |
15. 25℃时某些弱酸的电离平衡常数如表所示:
25℃时某些弱酸的电离平衡常数如表所示:
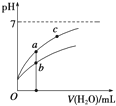
常温下,稀释CH3COOH、HClO两种酸时,溶液的pH随加水量变化的曲线如如图所示,下列说法正确的是( )
 25℃时某些弱酸的电离平衡常数如表所示:
25℃时某些弱酸的电离平衡常数如表所示:| CH3COOH | HClO | H2CO3 |
| K(CH3COOH) =1.8×10-5 | K(HClO) =3.0×10-8 | K(H2CO3)a1=4.4×10-7 K(H2CO3)a2=4.7×10-11 |
| A. | 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 图象中a、c两点所处的溶液中$\frac{c({P}^{-})}{c(HP).c(O{H}^{-})}$相等(HP代表CH3COOH或HClO) | |
| C. | 图象中a点酸的浓度大于b点酸的浓度 | |
| D. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO${\;}_{3}^{2-}$ |
16. A~H元素在元素周期表中的相对位置如图.A与E的原子序数相差3,E的一种单质是自然界中硬度最大的物质,D与H属同周期元素.下列判断正确的是( )
A~H元素在元素周期表中的相对位置如图.A与E的原子序数相差3,E的一种单质是自然界中硬度最大的物质,D与H属同周期元素.下列判断正确的是( )
 A~H元素在元素周期表中的相对位置如图.A与E的原子序数相差3,E的一种单质是自然界中硬度最大的物质,D与H属同周期元素.下列判断正确的是( )
A~H元素在元素周期表中的相对位置如图.A与E的原子序数相差3,E的一种单质是自然界中硬度最大的物质,D与H属同周期元素.下列判断正确的是( )| A. | 原子半径:H>F>E | |
| B. | 金属性:A>B>D | |
| C. | C与G的原子核外电子数相差3 | |
| D. | B的单质在空气中燃烧生成只含离子键的化合物 |