题目内容
16.关于沉淀溶解平衡和溶度积常数,下列说法不正确的是( )| A. | Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 | |
| B. | 将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp[CaSO4] | |
| C. | 已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,该温度下反应Fe(OH)3+3H+?Fe3++3H2O的平衡常数K=4.0×104 | |
| D. | 已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,在MgCl2溶液中加入氨水调混合液的pH=11,产生沉淀,则此时溶液中的c(Mg2+)=1.8×10-5mol•L-1 |
分析 A.Ksp是温度的常数;
B、溶度积表达式类型不同,不能说明大小;
C、依据溶度积常数以及水的离子积常数计算即可;
D、依据pH计算氢离子浓度,然后计算氢氧根浓度,再计算判断即可.
解答 解:A、Ksp是温度的常数,只随温度改变而改变,不同物质的溶解能力不同,与物质本身的性质有关,故A正确;
B、将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明硫酸钙的溶解度小,但溶度积表达式类型不同,不能说明大小,故B错误;
C、Ksp[Fe(OH)3]=c3(OH-)•c(Fe3+),反应的平衡常数K=$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$=4.0×104,故C正确;
D.测得混合液的pH=11,Ksp[Mg(OH)2]=c2(OH-)•c(Mg2+),c(OH-)=10-3,带入求得c(Mg2+)=1.8×10-3mol/L,故D正确;
故选:B.
点评 本题考查了沉淀溶解平衡的应用,溶度积计算分析,平衡移动方向的判断,题目难度中等.

练习册系列答案
相关题目
6.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 5.6 g铁粉在0.1 mol氯气中充分燃烧,转移电子数为0.3 NA | |
| B. | 1 2.5 mL1 6 mol•L-1浓硫酸与足量铜反应,转移电子数为0.2 NA | |
| C. | 7.8 gNa2S和Na2O2 的混合物中含有的阴离子数等于0.1 NA | |
| D. | 0.5 mol氧单质含有NA个O2 |
7.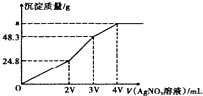 某混合溶液中含有溶质为NaCl、KI和Na2S各0.1mol,往该溶液在加入一定浓度的AgNO3溶液,产生沉淀的质量随加入AgNO3溶液的体积变化如图所示,则下列说法中不正确的是( )
某混合溶液中含有溶质为NaCl、KI和Na2S各0.1mol,往该溶液在加入一定浓度的AgNO3溶液,产生沉淀的质量随加入AgNO3溶液的体积变化如图所示,则下列说法中不正确的是( )
 某混合溶液中含有溶质为NaCl、KI和Na2S各0.1mol,往该溶液在加入一定浓度的AgNO3溶液,产生沉淀的质量随加入AgNO3溶液的体积变化如图所示,则下列说法中不正确的是( )
某混合溶液中含有溶质为NaCl、KI和Na2S各0.1mol,往该溶液在加入一定浓度的AgNO3溶液,产生沉淀的质量随加入AgNO3溶液的体积变化如图所示,则下列说法中不正确的是( )| A. | 所加AgNO3溶液的物质的量浓度为$\frac{0.1}{V}mol•{L}^{-1}$ | |
| B. | a的数值为62.65 | |
| C. | 常温下,AgCl,AgI,AgS在水中溶解能力依次减小 | |
| D. | 在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成 |
4.下列推论正确的( )
| A. | SiH4的沸点高于CH4,可推测PH3的沸点也高于NH3 | |
| B. | CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体 | |
| C. | PCl3 为三角锥形,可推测NF3也为三角锥形结构 | |
| D. | C2H6的碳链是直线型的,可推测C3H8的碳链也是直线型的 |
11.在 2L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.4kJ/mol
起始反应时NO和CO为4mol,10s达到化学平衡,测得N2为1mol.下列说法中正确的是( )
起始反应时NO和CO为4mol,10s达到化学平衡,测得N2为1mol.下列说法中正确的是( )
| A. | 反应前5 s内,用NO表示的平均反应速率为0.1 mol•L-1•S-1 | |
| B. | 达到平衡后,CO2的浓度与CO的浓度不同 | |
| C. | 当v正(CO)=2v逆(N2)时反应达到平衡 | |
| D. | 达到平衡后,升高温度,正反应速率将减小,逆反应速率将增大 |
1.某溶液中含有的离子是K+、NH4+、Fe2+、Fe3+、A13+、AlO2-、SO42-、CO32-、SiO32-、Cl-、NO3-中的某几种,已知各微粒的浓度均为0.1mol•L-1.现进行如下实验:
①取少量溶液加入足量的NaOH浓溶液,最终得到红褐色沉淀,并伴有气泡产生,过滤后的滤液中逐滴滴加稀硫酸至过量,过程中无沉淀产生.
②另取少量原溶液,加入稀硫酸溶液,有气体产生,并在空气中变为红色.
根据上述实验事实推断,有关该溶液的说法错误的是( )
①取少量溶液加入足量的NaOH浓溶液,最终得到红褐色沉淀,并伴有气泡产生,过滤后的滤液中逐滴滴加稀硫酸至过量,过程中无沉淀产生.
②另取少量原溶液,加入稀硫酸溶液,有气体产生,并在空气中变为红色.
根据上述实验事实推断,有关该溶液的说法错误的是( )
| A. | 至少含有4种离子 | |
| B. | 取少量原溶液先加入盐酸,后加入BaCl2溶液,肯定会产生白色沉淀 | |
| C. | 若原溶液中加入硝酸酸化的硝酸银溶液产生白色沉淀,则可推断溶液中含有K+ | |
| D. | 溶液中可能含有Fe3+、NH4+、SO42-、Cl-、NO3- |
8.化合物A、B是中学常见的物质,其阴阳离子可从下表中选择
(1)若A的水溶液为酸性,往B的水溶液加Al有气体产生,A、B的水溶液混合后,只产生不溶于稀硝酸的白色沉淀,①B的化学式为Ba(OH)2;
②A、B溶液混合后加热能产生气体的反应的离子方程式为H++SO42-+NH4++Ba2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$BaSO4↓+NH3↑+2H2O.
(2)若A的水溶液为浅绿色,B的焰色反应呈黄色.向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合后无明显变化.则
①A为FeI2;
②经分析上述过程中溶液变黄的原因可能有两种:
I仅有I-被氧化成I2使溶液呈黄色ⅡI-、Fe2+均被氧化使溶液呈黄色;
③请用一简易方法证明上述溶液变黄的原因取少量变黄溶液于试管中,滴加几滴KSCN溶液,若变红则Ⅱ合理,否则Ⅰ合理.
| 阳离子 | K+ Na+ NH+4 Fe2+ Ba2+ Cu2+ |
| 阴离子 | OH- I- NO3- AlO2- HCO3- HSO4- |
②A、B溶液混合后加热能产生气体的反应的离子方程式为H++SO42-+NH4++Ba2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$BaSO4↓+NH3↑+2H2O.
(2)若A的水溶液为浅绿色,B的焰色反应呈黄色.向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合后无明显变化.则
①A为FeI2;
②经分析上述过程中溶液变黄的原因可能有两种:
I仅有I-被氧化成I2使溶液呈黄色ⅡI-、Fe2+均被氧化使溶液呈黄色;
③请用一简易方法证明上述溶液变黄的原因取少量变黄溶液于试管中,滴加几滴KSCN溶液,若变红则Ⅱ合理,否则Ⅰ合理.
5.下列物质递变规律不能用元素周期律解释的是( )
| A. | 非金属性:C>Si | B. | 碱性:NaOH>Mg(OH)2 | ||
| C. | 酸性:H2SO3>H2CO3 | D. | 还原性:HI>HBr |
6.下列指定反应的离子方程式正确的是( )
| A. | Na2O与水反应:O2-+H2O═2OH- | |
| B. | SO2使氯水褪色:SO2+Cl2+2H2O═4H++SO42-+2Cl- | |
| C. | Na2SiO3溶液与盐酸反应:Na2SiO3+2H+═H2SiO3↓+2Na+ | |
| D. | Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3-+OH-═CaCO3↓+2H2O |