题目内容
1.为使Fe2+、Fe3+、Zn2+较完全地形成氢氧化物沉淀,溶液的酸碱度分别为pH 7.7、pH 4.5、pH 6.6.某硫酸锌酸性溶液中含有少量Fe2+,Fe3+杂质离子,为除去这些离子制得纯净的ZnSO4,应加入的试剂是( )| A. | NaOH溶液 | B. | 氨水 | C. | KMnO4,ZnCO3 | D. | H2O2,ZnO |
分析 为除去这些离子制得纯净的ZnSO4,应首先将Fe2+氧化为Fe3+,然后加入ZnO、ZnCO3等物质,调节溶液pH,使Fe3+水解生成沉淀而除去,以此解答.
解答 解:使Fe3+、Fe2+、Zn2+较完全的形成氢氧化物沉淀,溶液的pH应分别为3.7、9.6、4.4左右,所以要除去硫酸锌酸性溶液中含有少量Fe3+、Fe2+,应该把Fe2+氧化为Fe3+,双氧水是绿色氧化剂不会引入杂质,所以用双氧水把Fe2+氧化为Fe3,再加入氧化锌调节溶液的pH,使Fe3+转化为沉淀除去,
故选D.
点评 本题考查盐类水解的原理及应用,侧重于除杂与分离,题目较为基础,解答本题的关键是能把握除杂的原则.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
13.下列叙述正确的是( )
| A. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 | |
| B. | 有机物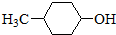 的消去产物有两种 的消去产物有两种 | |
| C. | 有机物C4H6O2能发生加聚反应,可推知其结构一定是CH2=CH-COOCH3 | |
| D. | 可用溴水鉴别苯酚、四氯化碳和乙酸 |
9.工业上以锂辉石(Li2O•A12O3•4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂.其部分工艺流程如图1:

已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
②不同温度下Li2CO3和Li2SO4的溶解度如下表:
(1)从滤渣1中分离出Al2O3的部分流程如下所示,括号中表示加入过量的试剂,方框表示所得到的物质.则步骤Ⅱ中反应的离子方程式是Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
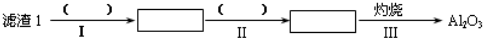
(2)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(3)工业上用电解法将Li2CO3粗品制成高纯Li2CO3,其中向电解后所得的纯LiOH溶液中加入过量NH4HCO3溶液可生成Li2CO3,反应的化学方程式是2LiOH+NH4HCO3=Li2CO3↓+NH3+2H2O.

已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
②不同温度下Li2CO3和Li2SO4的溶解度如下表:
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
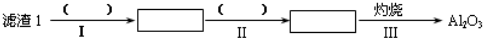
(2)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(3)工业上用电解法将Li2CO3粗品制成高纯Li2CO3,其中向电解后所得的纯LiOH溶液中加入过量NH4HCO3溶液可生成Li2CO3,反应的化学方程式是2LiOH+NH4HCO3=Li2CO3↓+NH3+2H2O.
6.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 5.6 g铁粉在0.1 mol氯气中充分燃烧,转移电子数为0.3 NA | |
| B. | 1 2.5 mL1 6 mol•L-1浓硫酸与足量铜反应,转移电子数为0.2 NA | |
| C. | 7.8 gNa2S和Na2O2 的混合物中含有的阴离子数等于0.1 NA | |
| D. | 0.5 mol氧单质含有NA个O2 |
13.150℃时,将1L混合烃与9L氧气混合,在密闭容器内充分燃烧,当恢复至150℃,体积恒定时,容器内压强增大8%,则该混合烃的组成是( )
| A. | 甲烷与乙烷体积比是1:4 | B. | 丙炔与乙炔体积比是1:4 | ||
| C. | 乙烯与丁烷体积比是1:4 | D. | 乙烯与丁烯体积比是1:4 |
10.下列关于元素的说法正确的是( )
| A. | 元素周期表中元素种类最多的周期是第6周期 | |
| B. | 第IA族元素均为碱金属元素 | |
| C. | 原子最外层电子数为2的元素一定位于第ⅡA族 | |
| D. | 元素周期表中元素种类最多的族是第Ⅷ族 |
11.在 2L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.4kJ/mol
起始反应时NO和CO为4mol,10s达到化学平衡,测得N2为1mol.下列说法中正确的是( )
起始反应时NO和CO为4mol,10s达到化学平衡,测得N2为1mol.下列说法中正确的是( )
| A. | 反应前5 s内,用NO表示的平均反应速率为0.1 mol•L-1•S-1 | |
| B. | 达到平衡后,CO2的浓度与CO的浓度不同 | |
| C. | 当v正(CO)=2v逆(N2)时反应达到平衡 | |
| D. | 达到平衡后,升高温度,正反应速率将减小,逆反应速率将增大 |
