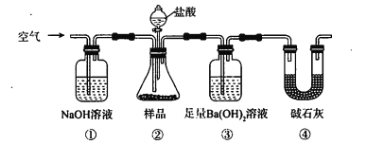
题目内容
【题目】某小组以黄铜矿(主要成分为 CuFeS2,含少量SiO2等杂质)为原料制备铜化工产品CuAlO2的一种工艺如下:
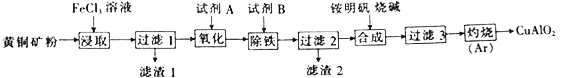
已知①过滤1所得滤液中含金属离子有:Cu2+、Fe2+和Fe3+,滤渣1的主要成分是SiO2和S;
②Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O。
(1)从产品纯度、环保操作方便等角度考虑,试剂A、B的最佳组合是__________(填代号)
a | b | c | d | |
A | HNO3 | NaClO | H2O2 (酸化) | H2O2 (酸化) |
B | Cu(OH)2 | NaOH | 氨水 | Cu(OH)2 CO3 |
(2)铵明矾的化学式为NH4Al(SO4)2·12H2O,它为制备铜的化工产品提供铝源。铵明矾溶液中NH4+、A13+、H+、OH-、SO42-浓度大小排序为_______________。
(3)过滤3得到A1(OH)3和Cu(OH)2,写出“灼烧”发生化学反应的方程式:_________________。
(4)单位时间内“浸取”Cu2+的百分率(称为浸出率)与溶液浓度、温度关系如下图所示。
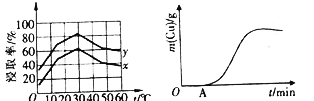
在20℃时,1L溶液中有效碰撞总次数:x_________y(填“>”“<”或“=”)。相同浓度下,温度高于30℃,“浸出率”降低的主要原因是_________________。
(5)以铜、石墨为电极,电解“过滤1”所得溶液制备铜,铜的质量与通电时间关系如上图所示。写出OA段阴极的反应方程式:___________________________。
(6)常温下,Ksp[Fe(OH)3]=4.0×10-38。加入试剂B调节pH=3时c(Fe3+)=_________mol/L
【答案】d c(SO42-)>c(NH4+)>c(Al3+)>c(H+)>c(OH-) 4Al(OH)3+4Cu(OH)2![]() 4CuAlO2+10H2O↑+O2↑ < 相同浓度、温度过高,Fe3+水解程度增大,Fe3+浓度减小 Fe3++e-=Fe2+ 4×10-5
4CuAlO2+10H2O↑+O2↑ < 相同浓度、温度过高,Fe3+水解程度增大,Fe3+浓度减小 Fe3++e-=Fe2+ 4×10-5
【解析】
黄铜矿(主要成分为CuFeS2)用FeCl3溶液氧化产生CuCl2、FeCl2、S单质,向溶解后的溶液中加入CuCl2、FeCl2、FeCl3氧化剂,可以将FeCl2氧化为FeCl3,然后加入一种物质既可以提高溶液的pH使Fe3+形成Fe(OH)3沉淀,又不引入杂质离子,然后向含有CuCl2溶液在加入铵明矾、NaOH,Al(OH)3、Cu(OH)2及Na2SO4、NaCl,然后将Al(OH)3、Cu(OH)2的混合物加热发生反应产生CuAlO2、H2O、O2,据此分析解答。
(1)A.HNO3还原产物是NO2、NO等大气污染物,不环保,A错误;
B.NaOH反应会引入杂质离子Na+,而且制取成本高,B错误;
C.氨水反应会产生氨气,导致大气污染,而且反应后溶液中含有杂质NH4+,C错误;
D. H2O2还原产物是H2O,Cu(OH)2CO3与溶液中的H+反应,不仅可提高溶液的pH,而且不会产生杂质离子,符合题目要求,D正确;
故合理选项是D;
(2) NH4Al(SO4)2·12H2O溶于水发生电离:NH4Al(SO4)2·12H2O=NH4++Al3++2SO42-+12H2O,可见c(SO42-)最大;在溶液中NH4+、Al3+发生水解反应而消耗,水解使溶液显酸性,所以c(H+)>c(OH-),由于Al(OH)3是两性氢氧化物,NH3H2O是碱,说明碱性:NH3H2O>Al(OH)3,根据盐的水解规律:碱越弱,碱电离产生的离子水解程度就越大,所以等浓度的NH4+和Al3+的水解程度:Al3+> NH4+,水解程度越大,溶液中离子浓度就越小,所以c(NH4+)>c(Al3+),盐水解程度总的来说是微弱的,盐电离产生的离子浓度远大于水电离产生的离子浓度,所以c(Al3+)>c(H+),故溶液中离子浓度大小关系为:c(SO42-)>c(NH4+)>c(Al3+)>c(H+)>c(OH-);
(3)过滤3得到A1(OH)3和Cu(OH)2,在“灼烧”时发生化学反应,根据电子守恒、原子守恒,可得该反应的方程式为:4Al(OH)3+4Cu(OH)2![]() 4CuAlO2+10H2O↑+O2↑;
4CuAlO2+10H2O↑+O2↑;
(4)在20℃时,1L溶液中有效碰撞总次数,物质的浸出率越高,溶液中离子浓度就越大,离子之间碰撞次数就越大,根据图象可知浸取率x<y,所以有效碰撞总次数x<y;在相同浓度下,当温度高于30℃,“浸出率”反而降低,主要原因是相同浓度、温度过高,Fe3+水解程度增大,Fe3+浓度减小;
(5)以铜、石墨为电极,电解“过滤1”所得溶液制备铜,Cu作阴极,连接电源的负极。“过滤1”所得溶液中含有CuCl2、FeCl2、FeCl3,由于电解后氧化性:FeCl3>CuCl2>FeCl2,所以在电解的初期,OA段阴极的电极反应式:Fe3++e-=Fe2+;当溶液中Fe3+反应完全后,发生反应:Cu2++2e-=Cu,所以阴极上Cu的质量增加,当溶液中Cu2+反应完全后,溶液中H+获得电子变为H2,因此阴极产生的Cu质量不再发生变化;
(6)常温下,Ksp[Fe(OH)3]=4.0×10-38。加入试剂B调节pH=3时,c(H+)=10-3mol/L,则c(OH-)=10-14÷10-3=10-11mol/L,由于c(Fe3+)c3(OH-)= Ksp[Fe(OH)3]=4.0×10-38,c(Fe3+)=4.0×10-38÷10-33=4.0×10-5mol/L。

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案【题目】某种胃药的有效成分为碳酸钙,测定其中碳酸钙含量的操作如下(设该药片中的其他成分不与盐酸或氢氧化钠反应):
①配制1.60mol/L稀盐酸和1.60mol/LNaOH溶液;
②向一粒研碎后的药片(1.60g)中加入20.00mL蒸馏水;
③用1.60mol/LNaOH溶液中和过量的稀盐酸,记录所消耗的NaOH溶液的体积;
④加入25.00mL1.60mol/L稀盐酸。
请回答下列问题:
(1)正确的操作顺序是__________________________(填序号)
(2)测定过程中发生反应的离子方程式为___________________________________、___________________________。
(3)该测定实验共进行了4次。4次测定所消耗的NaOH溶液的体积如下:
测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
V(NaOH(aq))/mL | 13.00 | 12.90 | 13.10 | 13.00 |
实验室现有50mL、100mL、250mL、500mL4种规格的容量瓶,则配制NaOH溶液应选用的容量瓶的规格为___________。
(4)①配制上述NaOH溶液时需要的主要仪器有托盘天平、烧杯、________________。
②该实验的第一步是计算,称取_____gNaOH固体。
③用烧杯称取NaOH固体时,下列操作步骤的正确顺序是__________________(相同的操作可重复使用)。
a.调整天平零点 b.将砝码放回砝码盒 c.将游码拨回零刻度处
d.称取小烧杯的质量 e.称取小烧杯和NaOH的质量 f.记录称量的数据
④称取NaOH固体时,若将砝码放在天平左盘,将NaOH固体放在右盘,游码在1.4的刻度线处。则实际称得的NaOH固体为____________g。
⑤写出下列操作对所配制的溶液浓度造成的影响(填“偏大”“偏小”或“不变”)。
a.称量时砝码与NaOH固体在托盘中位置颠倒:______________。
b.未洗涤烧杯及玻璃棒:______________。
c.定容摇匀后,发现液面低于刻度线,重新加水至刻度线:______________。
⑥取50mL上述配制准确的NaOH溶液,加水稀释至100mL,所得NaOH溶液的物质的量浓度为________________。