题目内容
【题目】化学兴趣小组的同学到化学实验室,用铝和氢氧化钠溶液反应来制备氢气。同学们取了3g纯铝片和40g一定质量分数的氢氧化钠溶液,充分反应后,铝片有剩余,称得反应后剩余物质的总质量为42.7g。试计算:
(1)生成氢气的质量是_____________g;
(2)所用氢氧化钠溶液的溶质质量分数_____________。
(提示:2Al+2NaOH+2H2O=2NaAlO2+3H2↑)
【答案】0.3 10%
【解析】
根据质量守恒定律可知,过程中质量的减少是因为生成了氢气,所以可以求算氢气的质量,根据氢气的质量和对应的化学方程式求算所用氢氧化钠溶液的溶质质量分数。
(1)根据质量守恒定律,生成的氢气的质量为3g+40g-42.7g=0.3g,故答案为:0.3;
(2)设所用氢氧化钠溶液的溶质质量分数为x,
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
80 6
40g![]() x 0.3g
x 0.3g
![]() 解得x=10%,
解得x=10%,
答:所用氢氧化钠溶液的溶质质量分数为10%。

【题目】(1)已知Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=2.6×10-39。常温下,某酸性CuCl2溶液中含有少量的FeCl3,为了得到纯净的CuCl2·2H2O晶体,应加入___________(填氧化物的化学式),调节溶液的pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗涤液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
①用稀盐酸溶解碳酸钙的离子方程式是_____________________________。
②已知:25 ℃时有关物质的溶度积
物质 | CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
Ksp | 2.8×10-9 | 9.1×10-6 | 1.8×10-11 | 6.8×10-6 |
根据数据,结合化学平衡原理解释清洗CaSO4的过程________________。(用溶解平衡表达式和必要的文字叙述加以说明);在步骤Ⅰ浸泡过程中还会发生反应MgCO3(s)+2OH-(aq)![]() Mg(OH)2(s)+CO32-(aq),该反应的平衡常数K=________(保留两位有效数字)。
Mg(OH)2(s)+CO32-(aq),该反应的平衡常数K=________(保留两位有效数字)。
③步骤Ⅲ中,加入Na2SO3溶液的目的是_______________________________。
【题目】下列各组物质,不能按如图(“→”表示反应一步完成)关系转化的是
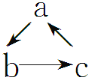
选 项 | a | b | c |
A | Al2O3 | NaAlO2 | Al(OH)3 |
B | Al | Al(OH)3 | Al2O3 |
C | AlCl3 | Al(OH)3 | NaAlO2 |
D | MgCl2 | Mg(OH)2 | MgO |
A. AB. BC. CD. D
【题目】某小组以黄铜矿(主要成分为 CuFeS2,含少量SiO2等杂质)为原料制备铜化工产品CuAlO2的一种工艺如下:

已知①过滤1所得滤液中含金属离子有:Cu2+、Fe2+和Fe3+,滤渣1的主要成分是SiO2和S;
②Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O。
(1)从产品纯度、环保操作方便等角度考虑,试剂A、B的最佳组合是__________(填代号)
a | b | c | d | |
A | HNO3 | NaClO | H2O2 (酸化) | H2O2 (酸化) |
B | Cu(OH)2 | NaOH | 氨水 | Cu(OH)2 CO3 |
(2)铵明矾的化学式为NH4Al(SO4)2·12H2O,它为制备铜的化工产品提供铝源。铵明矾溶液中NH4+、A13+、H+、OH-、SO42-浓度大小排序为_______________。
(3)过滤3得到A1(OH)3和Cu(OH)2,写出“灼烧”发生化学反应的方程式:_________________。
(4)单位时间内“浸取”Cu2+的百分率(称为浸出率)与溶液浓度、温度关系如下图所示。
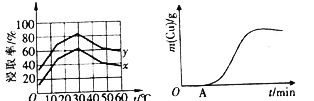
在20℃时,1L溶液中有效碰撞总次数:x_________y(填“>”“<”或“=”)。相同浓度下,温度高于30℃,“浸出率”降低的主要原因是_________________。
(5)以铜、石墨为电极,电解“过滤1”所得溶液制备铜,铜的质量与通电时间关系如上图所示。写出OA段阴极的反应方程式:___________________________。
(6)常温下,Ksp[Fe(OH)3]=4.0×10-38。加入试剂B调节pH=3时c(Fe3+)=_________mol/L

