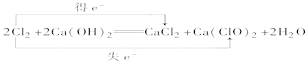��Ŀ����
����Ŀ�����ӽ���Ĥȼ�ϵ��(��ƣ�PEMFC)���ֳƹ���߷��ӵ����ȼ�ϵ�أ���һ���Ժ���ȼ����������ò���������������ȼ�ϵ�أ�Ĥ����ͼ���崮����ϳ�һ��ȼ�ϵ�ضѡ�Ŀǰ��������ȼ�ϵ�ر��ܵ�Դ�о�������Ա��עĿ�����Ľṹ���գ������¶ȵ�(ֻ��80��)������Ѹ�٣������ܶȸߣ�����������������ԭ����ͼ������˵����ȷ����( )
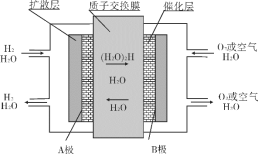
A. ����һ����̼���������ͼ������������(����)�γ����ӽ���Ĥȼ�ϵ�ء�
B. B���ĵ缫��ӦʽΪ��O2+4H++4e-=2H2O
C. �øõ����Ϊ����ͭ�ĵ�Դʱ��A�����ͭ�缫����
D. �����·��ת��0.1moleʱ��ͨ�����ӽ���Ĥ��H+����ĿΪ0.2NA
���𰸡�B
��������
����ͼ֪����ȼ�ϵ���У�����ʧ�������������ӣ�˵���������Һ�����ԣ�ͨ�������ĵ缫A�Ǹ�����������ӦʽΪ2H2-4e-=4H+��ͨ�������ĵ缫B�������������缫��ӦʽΪO2+4H++4e-=2H2O�����ӴӸ����ص����������������ӽ���Ĥֻ��������ͨ�����ݴ˷������
A.����һ����̼���������ͼ������������(����)������ֻ�л�ԭ����ȼ�ϣ�û������������ȼ�������ʲ����γ�ȼ�ϵ�أ�A����
B.ԭ������������������ƶ���B�缫�缫��ӦΪ��O2+4H++4e-=2H2O��B��ȷ��
C.�øõ����Ϊ����ͭ�ĵ�Դʱ����ͭ���������Դ����������AΪ������C����
D.���ڵ�������������������������ͬ�������෴�����Ե����·ת��0.1mol����ʱ��ͨ�����ӽ���Ĥ����������Ŀ0.1NA��D����
�ʺ���ѡ����B��

����Ŀ��ijС���Ի�ͭ��(��Ҫ�ɷ�Ϊ CuFeS2��������SiO2������)Ϊԭ���Ʊ�ͭ������ƷCuAlO2��һ�ֹ������£�
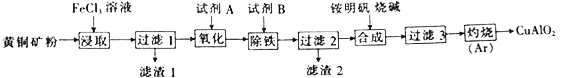
��֪�ٹ���1������Һ�к����������У�Cu2+��Fe2+��Fe3+������1����Ҫ�ɷ���SiO2��S��
��Cu(OH)2+4NH3��H2O=[Cu(NH3)4]2++2OH-+4H2O��
(1)�Ӳ�Ʒ���ȡ�������������ȽǶȿ��ǣ��Լ�A��B����������__________(�����)
a | b | c | d | |
A | HNO3 | NaClO | H2O2 (�ữ) | H2O2 (�ữ) |
B | Cu(OH)2 | NaOH | ��ˮ | Cu(OH)2 CO3 |
(2)������Ļ�ѧʽΪNH4Al(SO4)2��12H2O����Ϊ�Ʊ�ͭ�Ļ�����Ʒ�ṩ��Դ���������Һ��NH4+��A13+��H+��OH-��SO42��Ũ�ȴ�С����Ϊ_______________��
(3)����3�õ�A1(OH)3��Cu(OH)2��д����������������ѧ��Ӧ�ķ���ʽ��_________________��
(4)��λʱ��������ȡ��Cu2+�İٷ���(��Ϊ������)����ҺŨ�ȡ��¶ȹ�ϵ����ͼ��ʾ��
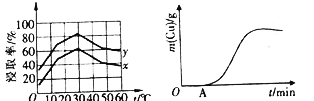
��20��ʱ��1L��Һ����Ч��ײ�ܴ�����x_________y(����>����<������=��)����ͬŨ���£��¶ȸ���30�棬�������������͵���Ҫԭ����_________________��
(5)��ͭ��ʯīΪ�缫�����������1��������Һ�Ʊ�ͭ��ͭ��������ͨ��ʱ���ϵ����ͼ��ʾ��д��OA�������ķ�Ӧ����ʽ��___________________________��
(6)�����£�Ksp[Fe(OH)3]=4.0��10-38�������Լ�B����pH=3ʱc(Fe3+)=_________mol/L