题目内容
15.下列说法正确的是( )| A. | pH=2与pH=1的硝酸中c(H+)之比为1:10 | |
| B. | Na2CO3溶液中c(Na+)与c(CO32-)之比为2:1 | |
| C. | 0.2 mol•L-1与0.1mol/L醋酸中c (H+)之比为2:1 | |
| D. | NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为3:1 |
分析 A.酸中c(H+)=10-pH;
B.碳酸钠是强碱弱酸盐,碳酸根离子水解;
C.醋酸是弱电解质,醋酸浓度越大其电离程度越小;
D.二氧化氮和水反应生成硝酸和NO,且硝酸和NO的物质的量之比是2:1,被氧化的二氧化氮占$\frac{2}{3}$,被还原的二氧化氮占$\frac{1}{3}$.
解答 解:A.酸中c(H+)=10-pH,所以pH=2与pH=1的硝酸中c(H+)之比=0.01mol/L:0.1mol/L=1:10,故A正确;
B.碳酸钠是强碱弱酸盐,碳酸根离子水解,所以c(Na+)与c(CO32-)之比大于2:1,故B错误;
C.醋酸是弱电解质,醋酸浓度越大其电离程度越小,所以0.2 mol•L-1与0.1mol/L醋酸中c(H+)之比小于2:1,故C错误;
D.二氧化氮和水反应生成硝酸和NO,且硝酸和NO的物质的量之比是2:1,被氧化的二氧化氮占$\frac{2}{3}$,被还原的二氧化氮占$\frac{1}{3}$,所以被氧化的n(NO2)与被还原的n(NO2)之比为2:1,故D错误;
故选A.
点评 本题考查盐类水解、pH的计算、氧化还原反应、弱电解质的电离等知识点,侧重考查学生分析计算能力,注意:弱电解质溶液浓度越小其电离程度越大,易错选项是C.

练习册系列答案
相关题目
8.随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用.为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种用离子变换法回收钒的新工艺,回收率达到91.7%.
部分含钒物质在水中的溶解性如下表所示:
该工艺的主要流程如图所示:
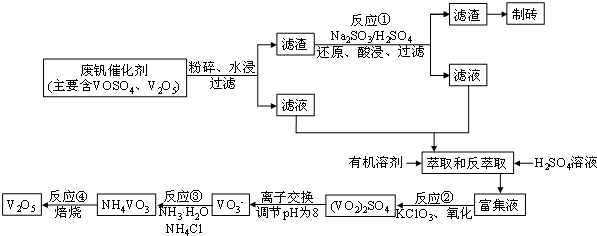
请问答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其化学方程式可表示为3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3
用铝热剂法从下列各金属氧化物中冶炼出各1mol对应的金属,耗铝粉的质量最多的是c(填序号)
a.Fe3O4 b.Ni2O3 c.V2O5 d.MnO2
(2)反应①的化学方程式为V2O5+Na2SO3+2H2SO4=2VOSO4+Na2SO4+2H2O
(3)若反萃取使用硫酸用量过大,进一步处理会增加NH3•H2O(填化学式)的用途,造成成本增大.
(4)反应②的化学方程式为:KClO3+6VOSO4+3H2O=3(VO2)2SO4+KCl+3H2SO4,若反应①用的还原剂与反应②用的氧化剂的物质的量之比为12:7,则废钒催化剂中VOSO4和V2O5的物质的量之比为3:2.
(5)该工艺反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式NH4++VO3-=NH4VO3↓
(6)用已知浓度的酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中的含钒量,已知该反应的还原产物为VO2+,氧化产物为CO2,则该反应的离子方程式为2VO2++H2C2O4+2H+=2 VO2++2 CO2↑+2 H2O.
(7)钒电池是以溶于一定浓度硫酸溶液中不同价态的钒离子(V2+、V3+、VO2+、VO2+)为正极和负极反应的活性物质,电极均为铂棒,电池总反应为:VO2++V3++H2O$?_{放电}^{充电}$V2++VO2++2H+
①放电时的正极反应为VO2++2H++e-═VO2++H2O
②充电时的阴极反应为V3++e-═V2+.
部分含钒物质在水中的溶解性如下表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

请问答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其化学方程式可表示为3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3
用铝热剂法从下列各金属氧化物中冶炼出各1mol对应的金属,耗铝粉的质量最多的是c(填序号)
a.Fe3O4 b.Ni2O3 c.V2O5 d.MnO2
(2)反应①的化学方程式为V2O5+Na2SO3+2H2SO4=2VOSO4+Na2SO4+2H2O
(3)若反萃取使用硫酸用量过大,进一步处理会增加NH3•H2O(填化学式)的用途,造成成本增大.
(4)反应②的化学方程式为:KClO3+6VOSO4+3H2O=3(VO2)2SO4+KCl+3H2SO4,若反应①用的还原剂与反应②用的氧化剂的物质的量之比为12:7,则废钒催化剂中VOSO4和V2O5的物质的量之比为3:2.
(5)该工艺反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式NH4++VO3-=NH4VO3↓
(6)用已知浓度的酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中的含钒量,已知该反应的还原产物为VO2+,氧化产物为CO2,则该反应的离子方程式为2VO2++H2C2O4+2H+=2 VO2++2 CO2↑+2 H2O.
(7)钒电池是以溶于一定浓度硫酸溶液中不同价态的钒离子(V2+、V3+、VO2+、VO2+)为正极和负极反应的活性物质,电极均为铂棒,电池总反应为:VO2++V3++H2O$?_{放电}^{充电}$V2++VO2++2H+
①放电时的正极反应为VO2++2H++e-═VO2++H2O
②充电时的阴极反应为V3++e-═V2+.
3.以下操作会使结果偏高的是( )
| A. | 在转移液体前容量瓶中有少量蒸馏水 | |
| B. | 定容摇匀后,液面已低于容量瓶刻度线,此时再加水 | |
| C. | 转移时有少许液体沿容量瓶外壁流到实验桌上 | |
| D. | 定容时俯视液面 |
10.下列各原子或离子的电子排布式错误的是( )
| A. | Ca2+ 1s22s22p63s23p6 | B. | O2-1s22s23p4 | ||
| C. | Cl- 1s22s22p63s23p6 | D. | Ar 1s22s22p63s23p6 |
20.下列操作能达到预期目的是( )
| A. | 检验卤代烃中是否含有氯,可将其与NaOH溶液共热后滴加AgNO3溶液即可 | |
| B. | 根据外加电源的阴极保护法,把钢闸门与外加电源的正极连接就可以被保护 | |
| C. | 将乙醇与浓的氢溴酸混合加热可以制备溴乙烷 | |
| D. | 做过银镜反应实验的试管内壁附着银,用稀氨水可以洗去 |
7.下列离子方程式书写正确的是( )
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 除去CO2中的SO2:SO2+CO32-═CO2↑+SO32- | |
| C. | 0.01 mol SO2气体通入10 mL 1 mol/L的NaOH溶液中:SO2+OH-═HSO3- | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
4.使用单质铜制取硝酸铜,最适宜的方法是:( )
| A. | Cu+稀HNO3 | B. | Cu$\stackrel{空气、△}{→}$CuO$\stackrel{硝酸}{→}$Cu(NO3)2 | ||
| C. | Cu+浓HNO3 | D. | Cu$\stackrel{Cl_{2}}{→}$CuCl2$\stackrel{AgNO_{3}}{→}$Cu(NO3)2 |
5.2010年诺贝尔物理奖授予发现石墨烯的开创性研究者,金刚石、石墨、C60和石墨烯的结构示意图分别如下图所示,下列说法不正确的是( )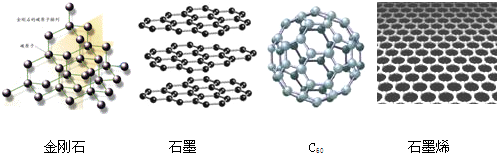

| A. | 金刚石和石墨烯中碳原子的杂化方式不同 | |
| B. | 金刚石、石墨、C60 和石墨烯的关系:互为同素异形体 | |
| C. | 这四种物质完全燃烧后的产物都是CO2 | |
| D. | 石墨与C60的晶体类型相同 |
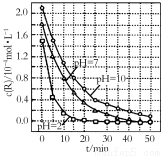
 强,R的降解速率越小
强,R的降解速率越小