题目内容
【题目】高铁酸钾(K2FeO4)是一新型、高效、无毒的多功能水处理剂。
(资料)K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4。

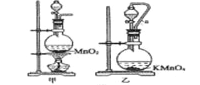
①A为制取氯气发生装置,其中盛放浓盐酸的仪器名称为___________。
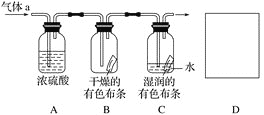
②除杂装置B中的试剂为___________。
③C为制备K2FeO4装置,KOH溶液过量的原因是___________。
④D为尾气处理装置,发生反应的离子方程式为___________。
(2)探究 K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黃绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
方案I | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
①由方案I中溶液变红可知a中含有___________。该离子的产生___________(填“能”或“不能”)判断一定是由K2FeO4被Cl-还原而形成的。
②方案Ⅱ用KOH溶液洗涤的目的是___________。方案Ⅱ得出氧化性:Cl2___________FeO42-(填“>”或“<”)
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:_______ FeO42-+______H+===_______O2↑+________Fe3++________(配平及完成上述离子方程式)________。现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况下)。则样品中高铁酸钾的质量分数约为___________。(计算结果保留到0.1%)
【答案】分液漏斗 饱和氯化钠溶液 K2FeO4微溶于KOH溶液,在碱性溶液中较稳定(或有利于生成K2FeO4) Cl2+2OH=Cl+ClO+H2O Fe3+ 不能 排除ClO的干扰,防止干扰后续实验 < 4 FeO42-+ 20 H+= 3 O2↑+ 4 Fe3++ 10H2O 79.2%
【解析】
(1)①A为氯气发生装置,由高锰酸钾和浓盐酸反应制取得到Cl2;
②装置B为除杂装置,浓盐酸会挥发出HCl气体,使得产生的Cl2中混有HCl,需要除去HCl,可将混合气体通过饱和食盐水达到除杂的目的;
③C为制备K2FeO4装置,根据题目信息解答;
④通过碱液吸收尾气,写出离子方程式。
(2)①方案I中加入KSCN溶液至过量,溶液呈红色,说明反应产生Fe3+,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,注意K2FeO4在碱性溶液中稳定,酸性溶液中快速产生O2,自身转化为Fe3+;
②方案Ⅱ可证明K2FeO4氧化了Cl-,使用KOH溶液溶出K2FeO4晶体,可以使K2FeO4稳定析出,并且除去ClO-离子,防止在酸性条件下ClO-和Cl-反应产生Cl2干扰实验;Fe(OH)3在碱性条件下被Cl2氧化为FeO42-,可以说明Cl2的氧化性大于FeO42-,而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系相反,方案Ⅱ是FeO42-在酸性条件下氧化Cl-生成Cl2,注意两种反应体系所处酸碱性介质不一样;
(3)利用质量守恒定律和电子守恒来配平反应的化学方程式并进行相关计算;
(1)①A为氯气发生装置,由高锰酸钾和浓盐酸反应制取得到Cl2,其中盛放浓盐酸的仪器名称为分液漏斗;
②装置B为除杂装置,反应使用浓盐酸,浓盐酸会挥发产生HCl,使得产生的Cl2中混有HCl,需要除去HCl,可将混合气体通过饱和食盐水达到除杂的目的;
③ 根据题目信息可知,K2FeO4微溶于KOH溶液,在碱性溶液中较稳定(或有利于生成K2FeO4 );
④通过碱吸收尾气,发生反应的离子方程式为:Cl2+2OH=Cl+ClO+H2O。
(2)①方案I中加入KSCN溶液至过量,溶液呈红色,说明反应产生Fe3+,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,注意K2FeO4在碱性溶液中稳定,酸性溶液中快速产生O2,自身转化为Fe3+,发生反应为:4FeO42-+20H+═4Fe3++3O2↑+10H2O;
②方案Ⅱ可证明K2FeO4氧化了Cl-,使用KOH溶液溶出K2FeO4晶体,可以使K2FeO4稳定析出,同时考虑到K2FeO4表面可能吸附ClO-,ClO-在酸性条件下可与Cl-反应生成Cl2,从而干扰实验,所以用KOH溶液洗涤的目的是:使K2FeO4稳定溶出,并把K2FeO4表面吸附的ClO-除尽,防止ClO-与Cl-在酸性条件下反应产生Cl2,避免ClO-干扰实验;Fe(OH)3在碱性条件下被Cl2氧化为FeO42-,可以说明Cl2的氧化性大于FeO42-,而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系相反,方案Ⅱ是FeO42-在酸性条件下氧化Cl-生成Cl2,两种反应体系所处酸碱性介质不一样,所以可以说明溶液酸碱性会影响粒子氧化性的强弱,方案Ⅱ得出氧化性:Cl2<FeO42-。
(3)反应中FeO42-→ Fe3+,Fe元素从+6价降到+3价,得3个电子,O元素从-2价升高到0价,失去2个电子,根据得失电子守恒,FeO42-的计量数为4,O2的计量数为3,再根据原子守恒配平方程式为: 4 FeO42-+ 20 H+= 3 O2↑+ 4 Fe3++ 10H2O ;/span>
4 FeO42-+ 20 H+= 3 O2↑+ 4 Fe3++ 10H2O得:
4K2FeO4~ ~3O2↑
792 96
x 0.672L×1.429g·L-1
792/x=96/0.672L×1.429g·L-1
x≈7.92g.
则样品中高铁酸钾的质量分数为:
7.92g÷10g×100%=79.2%。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】如图所示的过程是目前直接利用太阳能的研究热点。人们把通过人工光化学手段合成燃料的过程叫做人工光合作用。
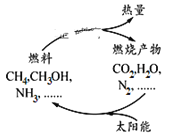
(1)在上图构想的物质和能量循环中太阳能最终转化为__________能。
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为CH3OH,该反应的化学方程式为:2CO2(g)+4H2O(g)![]() 2CH3OH(g)+3O2(g)。一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如下表所示:
2CH3OH(g)+3O2(g)。一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如下表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
n(CH3OH)/mol | 0.000 | 0.040 | 0.070 | 0.090 | 0.100 | 0.100 | 0.100 |
①平衡时,氧气的物质的量浓度为____;用H2O(g)表示0~3 min内该反应的平均反应速率为_____。
②能说明该反应已达到平衡状态的是_____________。
A.n(CH3OH) :n(O2)=2 :3 B.容器内气体密度保持不变
C.容器内气体压强保持不变 D.υ正(H2O)=2υ逆(CO2)
(3)用人工光合作用得到的甲醇、氧气和稀硫酸制作燃料电池,则氧气应通入该燃料电池的________极(填“正”或“负”),通入甲醇的一极的电极反应式为________________。