题目内容
11.25℃时,浓度均为0.1mol•L-1的HA溶液和BOH溶液,pH分别是1和12.下列说法正确的是( )| A. | 在0.1 mol•L-1BA溶液中,c(A-)+c(H+)=c(BOH)+c(OH-) | |
| B. | 若将0.1mol•L-1BOH溶液稀释至0.001 mol•L-1则溶液的pH=10 | |
| C. | 若将一定量的上述两溶液混合后pH=7,则混合液中:c(A-)>c(B+) | |
| D. | 若将上述两溶液按体积比l:2混合,则混合液中:c(B+)>c(A-)>c(OH-)>c(H+) |
分析 25℃时,浓度均为0.1mol•L-1的HA溶液和BOH溶液,pH分别是1和12,HA中氢离子浓度等于酸浓度,所以是强酸,BOH中氢氧根离子浓度小于碱浓度,所以BOH是弱碱,
A.任何电解质溶液中都存在电荷守恒,结合物料守恒分析;
B.弱电解质溶液中都存在电离平衡,加水稀释促进弱电解质电离;
C.混合溶液pH=7,则溶液中c(OH-)=c(H+),再结合电荷守恒判断;
D.将上述两溶液按体积比1:2混合,则两种溶液中溶质为BA和BOH,BOH的电离程度大于B+水解程度,再结合电荷守恒分析.
解答 解:25℃时,浓度均为0.1mol•L-1的HA溶液和BOH溶液,pH分别是1和12,HA中氢离子浓度等于酸浓度,所以是强酸,BOH中氢氧根离子浓度小于碱浓度,所以BOH是弱碱,
A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(B+)+c(H+)=c(A-)+c(OH-),根据物料守恒得c(BOH)+c(B+)=c(A?),则c(H+)=c(BOH)+c(OH-),故A错误;
B.弱电解质BOH溶液中都存在电离平衡,加水稀释促进BOH电离,所以将0.1mol•L-1BOH溶液稀释至0.OO1mol•L-1则溶液的pH>10,故B错误;
C.混合溶液pH=7,则溶液中c(OH-)=c(H+),溶液中存在电荷守恒c(B+)+c(H+)=c(A-)+c(OH-),所以得c(A-)=c(B+),故C错误;
D.将上述两溶液按体积比1:2混合,则两种溶液中溶质为BA和BOH,BOH的电离程度大于B+水解程度,所以溶液呈碱性,则c(OH-)>c(H+)、c(B+)>c(A-),所以离子浓度大小顺序是c(B+)>c(A-)>c(OH-)>c(H+),故D正确;
故选D.
点评 本题考查酸碱混合离子的浓度关系,明确信息中pH及离子的关系来判断酸碱的强弱是解答本题的关键,并熟悉电离、盐类水解等知识来解答,题目难度中等.

| A. | Al3+的结构示意图: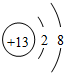 | B. | NaClO的电子式: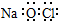 | ||
| C. | 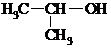 的名称:2-甲基乙醇 的名称:2-甲基乙醇 | D. | 乙醛分子的比例模型: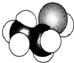 |
| 选项 | 操作 | 现象 | 结论 |
| A | 用玻璃杯蘸取X溶液沾到淀粉KI试纸上 | 试纸变蓝色 | X溶液可能是氯水 |
| B | 向稀HNO3和稀H2SO4中分别加入Fe粉 | 均有气泡冒出 | 两者均发生氧化还原反应 |
| C | 向酚酞溶液中加入过量的Na2O2 | 溶液先变红后褪色 | Na2O2与水生成的 碱有漂白性 |
| D | 将表面氧化的铜丝从酒精灯的外焰慢慢移向内焰 | 黑色的铜丝变红 | CuO被内焰中的乙醇蒸气还原 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 2NO2?N2O4-----①N2O4?2NO2--②,反应①的化学平衡常数是反应②的化学平衡常数的倒数 | |
| B. | 已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol将0.05mol/LBa(OH)2溶液100.0mL与0.05mol/LH2SO4溶液100.0mL混合,在298K101kPa条件下放热量为0.573kJ | |
| C. | 已知298K 时,0.10mol/L HAc的电离度为1.32%.在0.10mol/L HAc 和0.10mol/LNaAc的混合溶液20.00mL中,有如下变化: HAc?H++Ac----①,NaAc=Na++Ac-----②,Ac-+H2O?HAc+OH-----③,向该溶液中滴入几滴稀盐酸,溶液的pH保持相对稳定 | |
| D. | 将明矾与纯碱溶液混合,有沉淀产生,该沉淀的成分为碳酸铝 |
| A. | 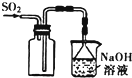 用图所示装置收集SO2气体 | |
| B. | 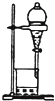 用图所示装置萃取碘水中的碘 | |
| C. | 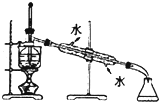 用图所示装置进行石油的分馏 | |
| D. | 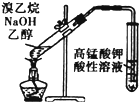 用图所示装置检验溴乙烷与NaOH乙醇溶液共热产生的乙烯 |
| A. | 断开lmol H-H键需要的能量大于断开1mol Cl-Cl键需要的能量 | |
| B. | 反应H2+C12=2HCl在光照和加热条件下的△H不同 | |
| C. | 反应①的活化能大于反应②的活化能 | |
| D. | 已知反应②的△H>O,则反应③的△H一定小于0 |
| A. | 室温时,NaHA溶液pH<7,是由于HA-的电离程度大于其水解程度 | |
| B. | 在0.1 mol/L的Na2A溶液中:c(A2-)+c(HA-)+c(H2A)=0.1 mol/L | |
| C. | 在0.1 mol/L的NaHA溶液中,一定有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | 向两份等体积NaHA、Na2A的浓度比为1:1的混合溶液中分别加入适当浓度的盐酸与氢氧化钠,其pH随加入酸、碱量的变化图象为: |
| A. | BeCl2分子的电子式: | |
| B. | 质子数为116,中子数为177的鉝(Lv)原子:${\;}_{116}^{293}$Lv | |
| C. | 氯离子的结构示意图: | |
| D. | 苯甲醇的结构简式: |
 .
.