题目内容
19.下列说法正确的是( )| A. | 2NO2?N2O4-----①N2O4?2NO2--②,反应①的化学平衡常数是反应②的化学平衡常数的倒数 | |
| B. | 已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol将0.05mol/LBa(OH)2溶液100.0mL与0.05mol/LH2SO4溶液100.0mL混合,在298K101kPa条件下放热量为0.573kJ | |
| C. | 已知298K 时,0.10mol/L HAc的电离度为1.32%.在0.10mol/L HAc 和0.10mol/LNaAc的混合溶液20.00mL中,有如下变化: HAc?H++Ac----①,NaAc=Na++Ac-----②,Ac-+H2O?HAc+OH-----③,向该溶液中滴入几滴稀盐酸,溶液的pH保持相对稳定 | |
| D. | 将明矾与纯碱溶液混合,有沉淀产生,该沉淀的成分为碳酸铝 |
分析 A、同一反应,平化学衡常数只受温度影响,与反应物浓度、体系的压强无关,温度相同,同一可逆反应的正、逆反应平衡常数互为倒数,对于一定温度下的同一个反应,其正反应和逆反应的化学平衡常数的乘积等于1;
B、Ba(OH)2溶液与H2SO4溶液混合还涉及钡离子与硫酸根离子反应的热效应;
C、根据平衡的移动,导致溶液中的氢离子的浓度变化不明显;
D、明矾与纯碱溶液混合,有沉淀产生,是铝离子与碳酸根离子的水解相互促进.
解答 解:A、温度是否相同不知,所以必须是同一温度下2NO2?N2O4-----①N2O4?2NO2--②,反应①的化学平衡常数是反应②的化学平衡常数的倒数,故A错误;
B、Ba(OH)2溶液与H2SO4溶液混合还涉及钡离子与硫酸根离子反应的热效应,所以放热量不等于0.573kJ,故B错误;
C、该溶液中滴入几滴稀盐酸,Ac-+H2O?HAc+OH-----③,平衡逆向移动,从而溶液中的氢离子的浓度变化不明显,所以溶液的pH保持相对稳定,故C正确;
D、明矾与纯碱溶液混合,有沉淀产生,是铝离子与碳酸根离子的水解相互促进,生成氢氧化铝沉淀,而不是碳酸铝,故D错误;
故选C.
点评 本题考查化学平衡常数、中和热、平衡的移动和双解的相关知识,综合性强,有一定的难度.

练习册系列答案
 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
9.H、C、N、Cl、Na、Al是常见的六种元素
(1)H位于元素周期表第1周期第ⅠA族;C的基态原子核外有2对成对电子;
Cl原子的价电子表示式3S23P5.
(2)用“>”、“=”、“<”填空
(3)用电子式表示Na Cl的形成过程: .
.
(4)已知在常温常压下:
写出H2与Cl2反应的热化学方程式:H2(g)+Cl2(g)═2HCl(g)△H=(a+c-2b)kJ•mol-1;.
(1)H位于元素周期表第1周期第ⅠA族;C的基态原子核外有2对成对电子;
Cl原子的价电子表示式3S23P5.
(2)用“>”、“=”、“<”填空
| 稳定性 | 得电子能力 | 离子半径 | 电负性 |
| CH4<NH3 | 1H=2H | Na+>Al3+ | C>Al |
 .
.(4)已知在常温常压下:
| 化学键 | H-H | H-Cl | Cl-Cl |
| 键能kJ/mol | a | b | c |
7.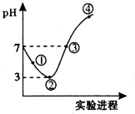 常温下,将Cl2缓慢通人100mL水中至饱和,然后向所得饱和氯水中逐滴加人0.1mol/LNaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )
常温下,将Cl2缓慢通人100mL水中至饱和,然后向所得饱和氯水中逐滴加人0.1mol/LNaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )
 常温下,将Cl2缓慢通人100mL水中至饱和,然后向所得饱和氯水中逐滴加人0.1mol/LNaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )
常温下,将Cl2缓慢通人100mL水中至饱和,然后向所得饱和氯水中逐滴加人0.1mol/LNaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )| A. | 曲线③④段有离子反应:HClO+OH-=ClO-+H2O | |
| B. | 可依据②处数据计算所溶解的n(Cl2) | |
| C. | ③处表示氯气与氢氧化钠溶液恰好反应完全 | |
| D. | ①处c(H+)约为②处c(H+)的两倍 |
14.为建设“蓝天常在、青山常在、绿水常在”的美丽中国,2015年4月16日国务院颁布了《水污染防治行动计划》.下列做法有利于该目标实现的是( )
| A. | 推广使用含磷洗涤剂 | B. | 用O3替代Cl2作饮用水消毒剂 | ||
| C. | 用工业污水直接灌溉农田 | D. | 含H2SO4的废水用BaCl2处理后排放 |
4.下列说法不正确的是( )
| A. | 晶体硅可用作制造太阳能电池和光导纤维 | |
| B. | 用饱和氯化铵溶液可以清洗金属表面的锈迹 | |
| C. | “地沟油”禁止食用,但可用来制生物柴油和肥皂 | |
| D. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
11.25℃时,浓度均为0.1mol•L-1的HA溶液和BOH溶液,pH分别是1和12.下列说法正确的是( )
| A. | 在0.1 mol•L-1BA溶液中,c(A-)+c(H+)=c(BOH)+c(OH-) | |
| B. | 若将0.1mol•L-1BOH溶液稀释至0.001 mol•L-1则溶液的pH=10 | |
| C. | 若将一定量的上述两溶液混合后pH=7,则混合液中:c(A-)>c(B+) | |
| D. | 若将上述两溶液按体积比l:2混合,则混合液中:c(B+)>c(A-)>c(OH-)>c(H+) |
8.常温下,下列电解质溶液的有关叙述,错误的是( )
| A. | NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大 | |
| B. | 在NaHCO3溶液中:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) | |
| C. | pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)相等 | |
| D. | 0.1 mol/L 的NaOH溶液和CH3COOH溶液等体积混合,则c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
9.氮及其化合物在工农业生产、生活中有重要作用.请按要求回答下列相关问题:
(1)食品添加剂铵明矾NH4Al(SO4)2•12H2O高温可分解,下列关于其分解产物的预测不合理的是C
A.NH3、N2、SO2、H2O
B.NH3、SO3、H2O
C.NH3、SO2、H2O
D.NH3、N2、SO3、SO2、H2O
(2)汽车发动机工作时也会引发N2和O2反应产生大气污染物NO,其能量变化示意图为图1: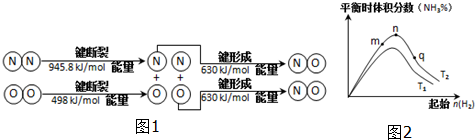
该反应的热化学方程式为N2(g)+O2(g)=2NO(g)△H=+183.8kJ/mol.
(3)工业合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图2示:
①比较在m、n、q三点所处的平衡状态中,反应物N2的转化率最高的是p点.
②T2条件下,在2L的密闭容器中,充入x mol N2和y mol H2时,3min达平衡,此时反应物的转化率均为a,
写出下列仅含a、x的表达式(不必化简):
v(N2)=$\frac{xa}{6}$mol•L-1•min-1;该反应的平衡常数的值K=$\frac{16(xa)^{2}}{(x-xa)(3x-3xa)^{3}}$.
③图象中T2低于T1(填“高于”、“低于”、“等于”或“无法确定”).
④科学家采用高质子导电性的SCY陶瓷(能传递H+ )实现氨的电化学合成,这提高了氮气和氢气的转化率.写出电化学合成过程中发生还原反应的电极方程式:N2+6H++6e-=2NH3.
(4)将质量相等的四份铁粉和铜粉的均匀混合物,分别加入同浓度稀硝酸充分反应,(假设硝酸的还原产物只有NO)实验数据如下表:
下列有关分析推断正确的是AC.
A.硝酸起始浓度为4mol/L
B.①中溶解了5.6g Fe
C.③中n(Cu2+)=0.15mol
D.④中V=6.72L.
(1)食品添加剂铵明矾NH4Al(SO4)2•12H2O高温可分解,下列关于其分解产物的预测不合理的是C
A.NH3、N2、SO2、H2O
B.NH3、SO3、H2O
C.NH3、SO2、H2O
D.NH3、N2、SO3、SO2、H2O
(2)汽车发动机工作时也会引发N2和O2反应产生大气污染物NO,其能量变化示意图为图1:

该反应的热化学方程式为N2(g)+O2(g)=2NO(g)△H=+183.8kJ/mol.
(3)工业合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图2示:
①比较在m、n、q三点所处的平衡状态中,反应物N2的转化率最高的是p点.
②T2条件下,在2L的密闭容器中,充入x mol N2和y mol H2时,3min达平衡,此时反应物的转化率均为a,
写出下列仅含a、x的表达式(不必化简):
v(N2)=$\frac{xa}{6}$mol•L-1•min-1;该反应的平衡常数的值K=$\frac{16(xa)^{2}}{(x-xa)(3x-3xa)^{3}}$.
③图象中T2低于T1(填“高于”、“低于”、“等于”或“无法确定”).
④科学家采用高质子导电性的SCY陶瓷(能传递H+ )实现氨的电化学合成,这提高了氮气和氢气的转化率.写出电化学合成过程中发生还原反应的电极方程式:N2+6H++6e-=2NH3.
(4)将质量相等的四份铁粉和铜粉的均匀混合物,分别加入同浓度稀硝酸充分反应,(假设硝酸的还原产物只有NO)实验数据如下表:
| 编 号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100mL | 200mL | 300mL | 400mL |
| 剩余金属/g | 18.0g | 9.6g | 0 | 0 |
| NO体积/L(标准状况下) | 2.24L | 4.48L | 6.72L | V |
A.硝酸起始浓度为4mol/L
B.①中溶解了5.6g Fe
C.③中n(Cu2+)=0.15mol
D.④中V=6.72L.
 己知A、B、C、D、E、F、G、H八种元素都是周期表中前四周期的元素,它们的核电荷数依次增大,A是原子半径最小的主族元素,B有三种不同的能级且每种能级上所含电子数相同,C的单质性质稳定且一种氢化物极易溶于水,D能形成两种互为同素异形体的气态单质,A、D、E的核内质子数之和与F的核内质子数相同,F的基态原子中有4个未成对电子,G比F原子多一个核内质子,上述H元素的+l价阳离子的K、L、M能层为全充满结构.
己知A、B、C、D、E、F、G、H八种元素都是周期表中前四周期的元素,它们的核电荷数依次增大,A是原子半径最小的主族元素,B有三种不同的能级且每种能级上所含电子数相同,C的单质性质稳定且一种氢化物极易溶于水,D能形成两种互为同素异形体的气态单质,A、D、E的核内质子数之和与F的核内质子数相同,F的基态原子中有4个未成对电子,G比F原子多一个核内质子,上述H元素的+l价阳离子的K、L、M能层为全充满结构.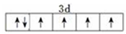 .在这两种离子之间Fe3+更稳定(填化学式):从微观结构角度解释该离子更稳定的原因:Fe3+离子的3d轨道为半满稳定状态.
.在这两种离子之间Fe3+更稳定(填化学式):从微观结构角度解释该离子更稳定的原因:Fe3+离子的3d轨道为半满稳定状态.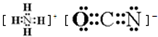
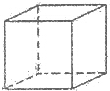
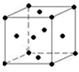 .该晶体中H原子直径为apm,H的相对原子质量为M,阿伏伽德罗常数为NA,求该晶胞密度表达式$\frac{\sqrt{2}M×1{0}^{30}}{{N}_{A}{a}^{3}}$g/cm3(用a,M,NA表示)
.该晶体中H原子直径为apm,H的相对原子质量为M,阿伏伽德罗常数为NA,求该晶胞密度表达式$\frac{\sqrt{2}M×1{0}^{30}}{{N}_{A}{a}^{3}}$g/cm3(用a,M,NA表示)