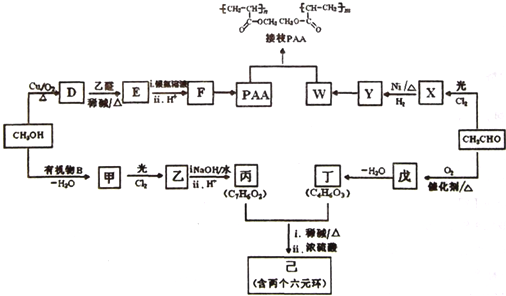
题目内容
16.反应H2+C12=2HCl(△H<0)的机理包含:①C12→2C1(慢)②H2+Cl→HCl+H (快)③C12+H→HCl+Cl(快)等.下列说法不正确的是( )| A. | 断开lmol H-H键需要的能量大于断开1mol Cl-Cl键需要的能量 | |
| B. | 反应H2+C12=2HCl在光照和加热条件下的△H不同 | |
| C. | 反应①的活化能大于反应②的活化能 | |
| D. | 已知反应②的△H>O,则反应③的△H一定小于0 |
分析 A.H-H键的键能小于Cl-Cl键,所以断裂Cl-Cl键需要的能量高;
B.根据盖斯定律可知,化学反应中的能量变化与反应途径无关;
C.Cl-Cl键键能大于H-H键,则反应①的活化能大于反应②;
D.设反应②H2+Cl→HCl+H (快)③C12+H→HCl+Cl(快)焓变分别为△H2、△H3,然后根据盖斯定律判断.
解答 解:A.由于H-H键的键能小于Cl-Cl键,则断开lmol H-H键需要的能量小于断开1mol Cl-Cl键,故A错误;
B.根据盖斯定律可知,反应H2+C12=2HCl无论在光照条件下还是在加热条件下反应,该反应的△H一定相同,故B错误;
C.反应①中需要断裂Cl-Cl键,反应②断裂H-H键,H-H键的键能小于Cl-Cl键,断裂Cl-Cl键需要能量高,则反应①的活化能大于②,故C正确;
D.设反应②H2+Cl→HCl+H (快)③C12+H→HCl+Cl(快)焓变分别为△H2、△H3,根据盖斯定律可知:H2+C12=2HCl(△H<0)的△H=△H2+△H3,则△H3=△H-△H2,由于△H<0、△H2>O,则△H3<0,故D正确;
故选B.
点评 本题考查了探究反应机理,题目难度中等,侧重考查化学反应与能量变化的关系,注意明确化学反应实质,能够根据盖斯定律判断反应中焓变大小.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案
相关题目
7.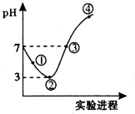 常温下,将Cl2缓慢通人100mL水中至饱和,然后向所得饱和氯水中逐滴加人0.1mol/LNaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )
常温下,将Cl2缓慢通人100mL水中至饱和,然后向所得饱和氯水中逐滴加人0.1mol/LNaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )
 常温下,将Cl2缓慢通人100mL水中至饱和,然后向所得饱和氯水中逐滴加人0.1mol/LNaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )
常温下,将Cl2缓慢通人100mL水中至饱和,然后向所得饱和氯水中逐滴加人0.1mol/LNaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )| A. | 曲线③④段有离子反应:HClO+OH-=ClO-+H2O | |
| B. | 可依据②处数据计算所溶解的n(Cl2) | |
| C. | ③处表示氯气与氢氧化钠溶液恰好反应完全 | |
| D. | ①处c(H+)约为②处c(H+)的两倍 |
4.下列说法不正确的是( )
| A. | 晶体硅可用作制造太阳能电池和光导纤维 | |
| B. | 用饱和氯化铵溶液可以清洗金属表面的锈迹 | |
| C. | “地沟油”禁止食用,但可用来制生物柴油和肥皂 | |
| D. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
11.25℃时,浓度均为0.1mol•L-1的HA溶液和BOH溶液,pH分别是1和12.下列说法正确的是( )
| A. | 在0.1 mol•L-1BA溶液中,c(A-)+c(H+)=c(BOH)+c(OH-) | |
| B. | 若将0.1mol•L-1BOH溶液稀释至0.001 mol•L-1则溶液的pH=10 | |
| C. | 若将一定量的上述两溶液混合后pH=7,则混合液中:c(A-)>c(B+) | |
| D. | 若将上述两溶液按体积比l:2混合,则混合液中:c(B+)>c(A-)>c(OH-)>c(H+) |
8.常温下,下列电解质溶液的有关叙述,错误的是( )
| A. | NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大 | |
| B. | 在NaHCO3溶液中:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) | |
| C. | pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)相等 | |
| D. | 0.1 mol/L 的NaOH溶液和CH3COOH溶液等体积混合,则c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
5.化学与环境?材料?信息?能源关系密切,下列说法不正确的是( )
| A. | 利用催化设施,可以将汽车尾气中CO和NO转化为无害气体 | |
| B. | 聚乙炔用I2或Na等做掺杂处理后可形成一种导电塑料,该导电塑料是一种纯净物,有固定的熔点?沸点 | |
| C. | 先通入氯气,再加入硫酸亚铁处理水,能达到消毒杀菌和除去悬浮杂质的目的 | |
| D. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是硅 |
6.下列装置能用于实验室制备HCl气体的是( )
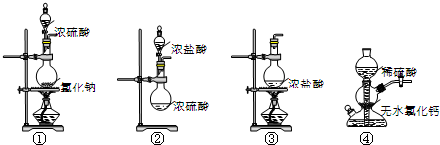

| A. | ①④ | B. | ②③ | C. | ①②③ | D. | ①③④ |
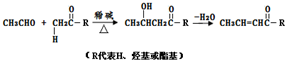
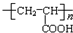 +HOCH2CH2OH$→_{△}^{浓硫酸}$
+HOCH2CH2OH$→_{△}^{浓硫酸}$ +2H2O.
+2H2O. +NaOH→
+NaOH→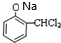 +H2O.
+H2O.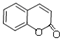 .
.