题目内容
1.“海底黑烟囱”是海底热泉将地壳深处金属、非金属化合物带出时逐渐沉积形成的烟囱状通道,含有铜、锌、锰、钻、镍等金属的硫化物及金、银、铂等贵金属.“海底黑烟囱”的研究对海底矿产资源的勘探及金属硫化物成矿过程的认识均有极大的推动作用.(1)“烟囱”周围的水样中发现了中子数是1,质子数是2的核素,该核素符号是
 .
.(2)“烟囱”内壁含有的结晶黄铁矿(主要成分是FeS2)在一定条件下发生如下反应:14CuSO4+5FeS2+12H2O═7X+5FeSO4+12H2SO4 X的化学式是Cu2S,氧化剂是CuSO4和FeS2
(3)“烟囱”外壁含有石膏(CaS04•2H20),在1400℃时能分解生成CaO,水蒸气和另外两种气体,其中一种气体可使品红溶液褪色.写出1400℃时石膏分解的化学方程式2CaSO4•2H2O$\frac{\underline{\;1400℃\;}}{\;}$2CaO+2SO2↑+O2↑+4H2O↑
(4)“烟囱”底部存在的难溶物ZnS遇CuSO4认溶液会慢慢转化为铜蓝(CuS).根据沉淀溶解平衡理论写出由ZnS转化为CuS的离子方程式ZnS(s)+Cu2+(aq)?Zn2+(aq)+CuS(s);若转化后溶液中c(Zn2+)=3.0×10-2mol•L-1,则c(Cu2+)=3.0×10-14mol•L-1〔已知Ksp(CuS)=1.0×10-36,Ksp(ZnS)=1.0×10-24
(5)“烟囱”中含有钻元素,LiCoO2可用作一种铿离子电池的正极材料.该锉离子电池充电过程中,负极发生的反应为6C+xLi++xe-═LixC6,正极发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池总反应方程式Li1-xCoO2+LixC6═6C+LiCoO2.
分析 (1)据其质子数和中子数确定质量数;
(2)据化学方程式中原子守恒确定X的化学式;氧化剂化合价降低;
(3)石膏(CaS04•2H20),在1400℃时能分解生成CaO,水蒸气和另外两种气体,其中一种气体可使品红溶液褪色,说明生成的气体是SO2和O2;
(4)据c(Zn2+)=3.0×10-2mol•L-1和Ksp(CuS)=1.0×10-36,Ksp(ZnS)=1.0×10-24计算c(Cu2+);
(5)据充电时负极反应式和正极转化书写电池反应式.
解答 解:(1)中子数是1质子数是2的核素是质量数为3的He原子,符号为 ,故答案为:
,故答案为: ;
;
(2)反应14CuSO4+5FeS2+12H2O═7X+5FeSO4+12H2SO4 中,据原子守恒可知,X为Cu2S;反应中,Cu元素化合价从+2降到+1价,有7molS的化合价从-1降到-2价,所以反应中的氧化剂为:CuSO4和FeS2,故答案为:Cu2S;CuSO4和FeS2;
(3)石膏(CaS04•2H20),在1400℃时能分解生成CaO,水蒸气和另外两种气体,其中一种气体可使品红溶液褪色,说明生成的气体是SO2和O2,反应方程式为:
2CaSO4•2H2O$\frac{\underline{\;1400℃\;}}{\;}$2CaO+2SO2↑+O2↑+4H2O↑,故答案为:2CaSO4•2H2O$\frac{\underline{\;1400℃\;}}{\;}$2CaO+2SO2↑+O2↑+4H2O↑;
(4)ZnS转化为CuS的离子方程式为:ZnS(s)+Cu2+(aq)?Zn2+(aq)+CuS(s);Ksp(ZnS)=c(Zn2+)•c(S2-)=1.0×10-24,c(Zn2+)=3.0×10-2mol•L-1,则c(S2-)=$\frac{1}{3}$×10-22,Ksp(CuS)=1.0×10-36,所以c(Cu2+)=$\frac{1.0×1{0}^{-36}}{\frac{1}{3}×1{0}^{-22}}$=3.0×10-14,
故答案为:ZnS(s)+Cu2+(aq)?Zn2+(aq)+CuS(s);3.0×10-14;
(5)放电时,负极反应为:LixC6-xe-═6C+xLi+,正极Li1-xCoO2+xLi++xe-=LiCoO2,总电池反应方程式为:Li1-xCoO2+LixC6═6C+LiCoO2,
故答案为:Li1-xCoO2+LixC6═6C+LiCoO2.
点评 本题考查了核素的表示方法、氧化还原反应方程式书写以及氧化剂的判断、沉淀的转化、电极反应式以及电池反应方程式书写,题目难度大.

| A. | 在0.1 mol•L-1BA溶液中,c(A-)+c(H+)=c(BOH)+c(OH-) | |
| B. | 若将0.1mol•L-1BOH溶液稀释至0.001 mol•L-1则溶液的pH=10 | |
| C. | 若将一定量的上述两溶液混合后pH=7,则混合液中:c(A-)>c(B+) | |
| D. | 若将上述两溶液按体积比l:2混合,则混合液中:c(B+)>c(A-)>c(OH-)>c(H+) |
| A. | 玻璃、水泥、水晶都是硅酸盐制品 | |
| B. | 蚕丝和棉花的组成元素相同,结构不同,因而性质不同 | |
| C. | 石油的分馏和煤的气化、液化,涉及的都是物理变化 | |
| D. | 纤维素不能被人体消化吸收,但能促进肠道的蠕动,对人体有益 |
(1)食品添加剂铵明矾NH4Al(SO4)2•12H2O高温可分解,下列关于其分解产物的预测不合理的是C
A.NH3、N2、SO2、H2O
B.NH3、SO3、H2O
C.NH3、SO2、H2O
D.NH3、N2、SO3、SO2、H2O
(2)汽车发动机工作时也会引发N2和O2反应产生大气污染物NO,其能量变化示意图为图1:
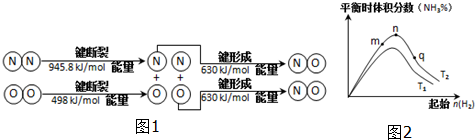
该反应的热化学方程式为N2(g)+O2(g)=2NO(g)△H=+183.8kJ/mol.
(3)工业合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图2示:
①比较在m、n、q三点所处的平衡状态中,反应物N2的转化率最高的是p点.
②T2条件下,在2L的密闭容器中,充入x mol N2和y mol H2时,3min达平衡,此时反应物的转化率均为a,
写出下列仅含a、x的表达式(不必化简):
v(N2)=$\frac{xa}{6}$mol•L-1•min-1;该反应的平衡常数的值K=$\frac{16(xa)^{2}}{(x-xa)(3x-3xa)^{3}}$.
③图象中T2低于T1(填“高于”、“低于”、“等于”或“无法确定”).
④科学家采用高质子导电性的SCY陶瓷(能传递H+ )实现氨的电化学合成,这提高了氮气和氢气的转化率.写出电化学合成过程中发生还原反应的电极方程式:N2+6H++6e-=2NH3.
(4)将质量相等的四份铁粉和铜粉的均匀混合物,分别加入同浓度稀硝酸充分反应,(假设硝酸的还原产物只有NO)实验数据如下表:
| 编 号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100mL | 200mL | 300mL | 400mL |
| 剩余金属/g | 18.0g | 9.6g | 0 | 0 |
| NO体积/L(标准状况下) | 2.24L | 4.48L | 6.72L | V |
A.硝酸起始浓度为4mol/L
B.①中溶解了5.6g Fe
C.③中n(Cu2+)=0.15mol
D.④中V=6.72L.
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
| A. | ①④ | B. | ②③ | C. | ①②③ | D. | ①③④ |
| A. | H2 | B. | 2H | C. | 2H+ | D. | 2H2 |
| A. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| B. | 等物质的量的NaClO、NaHCO3的混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) | |
| C. | 0.01mol•L-1NaOH溶液与等体积pH=2的醋酸溶液混合后的溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 醋酸钠、盐酸两溶液混合后呈中性的溶液中:c(Na+)>c(Cl-)>c(CH3COOH) |