题目内容
2. 中学化学常见元素氮、磷、钾与氢、氧、卤素等能形成多种化合物.
中学化学常见元素氮、磷、钾与氢、氧、卤素等能形成多种化合物.回答下列问题:
(1)氮、磷、钾三种元素的第一电离能由大到小的顺序是N>P>K(用元素符号表示).
(2)叠氮酸(HN3)是一种弱酸,可电离出H+和N3-.
①N3-的立体构型是直线形:与N3-互为等电子体的一种分子是N2O或CO2或CS2等(填分子式).
②叠氮化物能与Co3+形成[Co(N3)(NH3)5]SO4,该配合物中心离子的配位数为6;基态钴原子的价层电子排布式为3d74s2
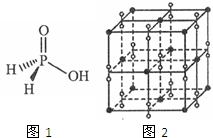
(3)磷能形成多种含氧酸,某资料认为次磷酸的结构如图1.按此结构,P原子采用的杂化方式为sp3,次磷酸分子中σ键与π键数目之比为5:1,次磷酸属于弱酸(填“强”或“弱”),lmol次磷酸最多能与1mo1NaOH发生中和反应.
(4)己知钾的一种化合物KIC12受热可分解,倾向于生成晶格能更大的物质.则下列化学反应更易发生的是AA.KICl2=KCl+ICl B.KICl2=KI+Cl2
(5)钾在氧气中燃烧时得到多种氧化物,其中一种是面心立方结构,晶胞结构如图2所示.若该氧化物的密度是ρg.cm-3,则晶胞中最近的两个钾离子间的距离为$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{284}{ρ{N}_{A}}}$cm(只要求列算式,不必计算出数值,用NA表示阿伏加德罗常数的值).
分析 (1)同主族自上而下第一电离能减小,金属性越强,第一电离能越小;
(2)①原子个数相等且价电子数相等的微粒为等电子体,N3-与CO2互为等电子体,二者结构相似;
②[Co(N3)(NH3)5]SO4中配体为N3-、NH3;根据能量最低原理书写基态钴原子的价层电子排布式;
(3)由次磷酸的结构可知,P原子成4个σ键、没有孤电子对;单键为σ键,双键含有1个σ键、1个π键;
分子中羟基氧与非羟基数目一般相差2为强酸;只有羟基中H发生电离,与氢氧化钠发生反应;
(4)离子晶体的晶格能与离子半径成反比,与离子所带电荷成正比;
(5)根据原子之间存在的化学键知,黑色小球表示K原子,白色球表示O原子,根据均摊法计算晶胞中K原子数目、氧原子数目,进而计算晶胞的质量,再结合m=ρV计算晶胞体积,而晶胞棱长b=$\root{3}{V}$,顶点K原子与面心K原子之间的距离最近,该距离为$\frac{\sqrt{2}}{2}$b.
解答 解:(1)同主族自上而下第一电离能减小,金属性越强,第一电离能越小,故第一电离能:N>P>K,
故答案为:N>P>K;
(2)①原子个数相等且价电子数相等的微粒为等电子体,则与N3-互为等电子体的分子有:N2O或CO2或CS2等,N3-与CO2互为等电子体,二者结构相似,为直线型结构,
故答案为:直线型;N2O或CO2或CS2等;
②[Co(N3)(NH3)5]SO4中配体为N3-、NH3,中心离子的配位数为1+5=6;
Co原子核外电子数为27,根据能量最低原理,基态钴原子的核外电子排布式为1s22s22p63s23p63d74s2,价电子排布式为3d74s2,
故答案为:6;3d74s2;
(3)由次磷酸的结构可知,P原子成4个σ键、没有孤电子对,杂化轨道数目为4,P原子采用的杂化方式为 sp3;P原子形成3个单键、1个双键,氧原子与H原子之间形成单键,单键为σ键,双键含有1个σ键、1个π键,次磷酸分子中σ键与π键数目之比为5:1;分子中羟基氧与非羟基数目一般相差2为强酸,而次磷酸中羟基氧与非羟基数目相等,属于弱酸;只有羟基中H发生电离,与氢氧化钠发生反应,lmol次磷酸最多能与1mo1NaOH发生中和反应,
故答案为:sp3;5:1;弱;1;
(4)已知KICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,而离子电荷越多、半径越小晶格能越大,晶格能KCl>KI,所以发生的反应为KICl2=KCl+ICl,故选:A;
(5)根据原子之间存在的化学键知,黑色小球表示K原子,白色球表示O原子,该晶胞中K原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,O原子个数=(2+12×2×$\frac{1}{4}$)=8,该晶胞中K、O原子个数之比=4:8=1:2,则化学式为KO2,晶胞的质量为$\frac{4×39+8×16}{{N}_{A}}$g,密度是ρg.cm-3,晶胞棱长b=$\root{3}{\frac{\frac{4×39+8×16}{{N}_{A}}}{ρ}}$cm=$\root{3}{\frac{284}{ρ{N}_{A}}}$cm,顶点K原子与面心K原子之间的距离最近,该距离为$\frac{\sqrt{2}}{2}$b=$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{284}{ρ{N}_{A}}}$cm,
故答案为:$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{284}{ρ{N}_{A}}}$.
点评 本题是对物质结构的考查,涉及电离能、核外电子排布、化学键、等电子体、晶胞计算等,需要学生具备扎实的基础,(5)中计算为易错点,对学生空间想象与数学计算能力有一定的要求,难度中等.

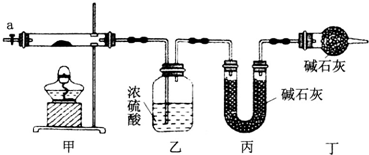
(1)按如图所示装置组装好仪器,并检查装置气密性;称取3.65g样品置于硬质玻璃管内,加热,当乙装置中不再有气泡产生时(填实验现象),停止加热;打开活塞a,缓缓通入空气数分钟,通入空气的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中.
(2)某同学认为上述实验中存在一个缺陷,该缺陷是未考虑空气中的水蒸气和二氧化碳对实验的影响.
(3)通过正确实验测得乙、丙装置增重分别为0.36g、0.88g,则该碱式碳酸钴的化学式为Co3(OH)4(CO3)2.
(4)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取COCl2•6H2O的一种工艺如下:

已知;25℃时
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为Fe(OH)3和Al(OH)3;
③加盐酸调整pH为2~3的目的为抑制CoCl2的水解;
④操作Ⅱ过程为蒸发浓缩、冷却结晶、过滤.
| A. | 导致易拉罐变瘪的离子反应是CO2+OH-=HCO3- | |
| B. | 导致易拉罐又鼓起来的反应是Al3++3HCO3-=Al(OH)3+3CO2↑ | |
| C. | 上述过程中共发生了三个化学反应,且反应结束后的溶液呈碱性 | |
| D. | 若将CO2换为NH3,浓NaOH溶液换为水,易拉罐也会出现先瘪后鼓的现象 |
| A. | 铝具有很强的抗腐蚀能力,是因为其不易与氧气发生反应 | |
| B. | 棉布,羊毛和绦纶燃烧后都生成二氧化碳和水 | |
| C. | 航天飞机上的陶瓷防护片属于新型无机非金属材料 | |
| D. | 食品保鮮膜、塑料水杯等生活用品的主要成分是聚氯乙烯 |
| 选项 | 离子组 | 加入试剂(溶液) | 加入试剂后发生反应的离子方程式 |
| A | K+、Fe3+、NO3-、SO42- | 少量KSCN | Fe3++3SCN-=Fe(SCN)3 |
| B | Na+、AlO2-、Cl-、OH- | 过量NaHCO3 | OH-+HCO3-=CO32-+H2O |
| C | H+、Ba2+、Al3+、HCO3- | 少量NaOH | Al3++3OH-=Al(OH)3↓ |
| D | K+、Na+、S2O32-、Cl- | 过量硫酸 | 2S2O32-+2H+=SO42-+3S↓+H2O2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 碱在水中的溶解度 | B. | 乙酸溶液的pH | ||
| C. | 合成氨的反应热 | D. | 醋酸钠溶液中的氢氧根离子浓度 |
| A. | I A族和ⅦA族元素间可形成共价化合物或离子化合物 | |
| B. | 因H2SO3的酸性比H2CO3强,所以S的非金属性比C强 | |
| C. | H2O2、CH3CH3、Cl-、K+中的电子数和质子数均分别相等 | |
| D. | Na+、Al3+、O2-、F-的半径逐渐减小 |
| A. | 食盐 | B. | 蔗糖 | C. | 白醋 | D. | 面粉 |
| A. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| B. | 除去苯中混有的少量苯酚,加入适量NaOH溶液,振荡、静置后分液 | |
| C. | 蛋白质溶液中加入硫酸铜溶液,有沉淀产生,加水,沉淀重新溶解 | |
| D. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |