题目内容
15.H2和O2的混合气体,在120℃和1.01×105Pa下体积为aL,点燃使其反应后恢复至原条件,其体积变为bL,则原混合气体中O2为( )| A. | b L | B. | (b-a)L | C. | (2a-b)L | D. | (2b-a)L |
分析 根据题意可以知道,同温、同压下,相同体积的不同气体分子中含有相同数目分子,所以结合氢气和氧气反应的化学方程式可以知道反应中氢气和氧气反应的体积之比为2:1,由于没有指明各物质的体积关系,所以在反应时有三种情况:①恰好完全反应,②氧气剩余,③氢气剩余,所以可以据此结合化学方程式来完成解答.
解答 解:氢气和氧气反应的化学方程式为:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$ 2H2O,在120℃和1.01×105Pa压强下,生成的水也是以气体的状态存在的,
①如果氢气和氧气恰好完全根据化学方程式可以知道,氧气占总体积的三分之一,即原混合气体中氧气的体积为:$\frac{1}{3}$aL;
②如果氧气过量,则设反应的氧气的体积为x,则:
2H2+O2$\frac{\underline{\;点燃\;}}{\;}$ 2H2O,
2 1 2
2x x 2x
根据反应前后剩余的氧气的质量相等得:
aL-(2x+x)=bL-2x
解得:x=(a-b)L;
所以原混合气体中氧气的体积为:aL-2x=aL-2(a-b)L=(2b-a)L;
③若氢气过量,则设氧气的体积为y,则:
2H2+O2$\frac{\underline{\;点燃\;}}{\;}$ 2H2O,
2 1 2
2y y 2y
根据反应前后剩余的氢气的质量相等得:
aL-(2y+y)=bL-2y
解得:y=(a-b)L
即原混合气体中氧气的体积为(a-b)L;
根据上述计算可以知道原混合气体中氧气的体积可能为:$\frac{1}{3}$aL、(a-b)L或(2b-a)L,分析所给的选项可以知道选项D是正确的,故选D.
点评 本题有一定难度,考查同学们的新信息的获取能力、处理能力及灵活运用进行解题的能力.

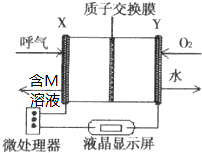 查处酒后驾驶所采用的“便携式乙醇测量仪”,以燃料电池为工作原理,如图,两电极材料均为Pt.理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为M,其中一个电极的反应式为:CH3CH2OH-2e-→M+2H+.下列说法中正确的是( )
查处酒后驾驶所采用的“便携式乙醇测量仪”,以燃料电池为工作原理,如图,两电极材料均为Pt.理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为M,其中一个电极的反应式为:CH3CH2OH-2e-→M+2H+.下列说法中正确的是( )| A. | 电池内部H+向X极移动 | |
| B. | 另一极Y极的电极反应式为:O2+4e-+2H2O=4OH- | |
| C. | 乙醇在X极上发生还原反应,电子经过外电路流向Y极 | |
| D. | 电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O |
| A. | NH${\;}_{4}^{+}$+D2O?NH3•D2O+H+ | B. | NH${\;}_{4}^{+}$+D2O?NH3•HDO+D+ | ||
| C. | c(OD-)•c(H+)=Kw | D. | c(OH-)•c(D+)=Kw |
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 102 | 74 |
| 主要化合价 | +2 | +3 | +6、+4、-2 | -2 |
| A. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| B. | 气态氢化物的稳定性H2Z<H2W | |
| C. | X、Y元素的金属性X<Y | |
| D. | 一定条件下,Z单质与W的常见单质直接生成ZW3 |
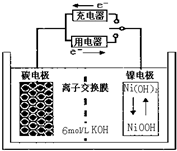
| A. | 充电时碳电极上发生还原反应 | |
| B. | 充电时Ni电极与电源的正极相连 | |
| C. | 放电时碳电极反应为H2-2e-=2H+ | |
| D. | 放电时Ni电极反应为Na(OH)+H2O+e-=Ni(OH)2+OH- |
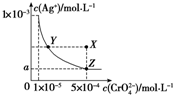
| A. | T℃时,在Y点和Z点,Ag2CrO4的Ksp相等 | |
| B. | 向饱和AgCrO4溶液中加入固体K2CrO4不能使溶液由Y点变为X点 | |
| C. | T℃时,Ag2CrO4的Ksp为1×10-8 | |
| D. | 图中a=$\sqrt{2}$×10-4 |
 和双酚A:
和双酚A: 缩聚而成,其反应方程式为
缩聚而成,其反应方程式为 .
.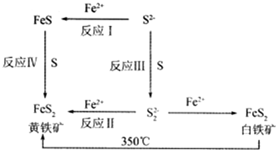 Ⅰ.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-═Li2S+Fe,则该电池的总反应式为2Li+FeS═Li2S+Fe.
Ⅰ.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-═Li2S+Fe,则该电池的总反应式为2Li+FeS═Li2S+Fe.