题目内容
5.在T℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示.下列说法中不正确的是( )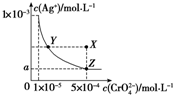
| A. | T℃时,在Y点和Z点,Ag2CrO4的Ksp相等 | |
| B. | 向饱和AgCrO4溶液中加入固体K2CrO4不能使溶液由Y点变为X点 | |
| C. | T℃时,Ag2CrO4的Ksp为1×10-8 | |
| D. | 图中a=$\sqrt{2}$×10-4 |
分析 A、一定温度下溶度积是常数,随温度变化,不随浓度变化;
B、在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上;
C、依据 图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,溶度积是饱和溶液中离子浓度幂次方的乘积;
D、溶度积常数不变,依据溶液中Z点时离子浓度计算;
解答 解:A、一定温度下溶度积是常数,随温度变化,不随浓度变化,所以t℃时,Y点和Z点时Ag2CrO4的Ksp相等,故A正确;
B、在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,故B正确;
C、依据 图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶剂平衡为:Ag2CrO4(s)?2Ag++CrO42-;
Ksp=c2(Ag+)•c(CrO42-)=(10-3)2×10-5=10-11;故C错误;
D、依据溶度积常数计算Ksp(Ag2CrO4)=c2(Ag+)•c(CrO42-)=1×10-11,Z点时c(CrO42-)=5×10-4,则c(Ag+)2=2×10-8,所以a=$\sqrt{2}$×10-4,故D正确;
故选C.
点评 本题考查了沉淀溶解平衡的分析判断,溶度积常数的计算应用,注意溶度积只随温度变化,题目难度中等.

练习册系列答案
 目标测试系列答案
目标测试系列答案
相关题目
15.H2和O2的混合气体,在120℃和1.01×105Pa下体积为aL,点燃使其反应后恢复至原条件,其体积变为bL,则原混合气体中O2为( )
| A. | b L | B. | (b-a)L | C. | (2a-b)L | D. | (2b-a)L |
10.以下是25℃时几种难溶电解质的溶解度:
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子.例如:①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可; ②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,再加入足量的氢氧化镁,充分反应,过滤结晶即可; ③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,再加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.请回答下列问题:
(1)上述三个除杂方案都能够达到很好的效果,Fe3+、Fe2+ 都被转化为Fe(OH)3(填名称)而除去.
(2)①中加入的试剂应该选择氨水为宜,其原因是不会引入新的杂质.
(3)②中除去Fe3+时所发生的总反应的离子方程式为2Fe3+(aq)+3Mg(OH)2(s)═3Mg2+(aq)+2Fe(OH)3(s).
(4)下列与方案③相关的叙述中,正确的是ACDE(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
(1)上述三个除杂方案都能够达到很好的效果,Fe3+、Fe2+ 都被转化为Fe(OH)3(填名称)而除去.
(2)①中加入的试剂应该选择氨水为宜,其原因是不会引入新的杂质.
(3)②中除去Fe3+时所发生的总反应的离子方程式为2Fe3+(aq)+3Mg(OH)2(s)═3Mg2+(aq)+2Fe(OH)3(s).
(4)下列与方案③相关的叙述中,正确的是ACDE(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.
17.全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,原理如图所示.若负载是镀铜的电镀槽,则左槽溶液由黄色逐渐变为蓝色,有关说法正确的是( )


| A. | 外接负载时,左槽作为原电池负极,发生氧化反应 | |
| B. | 外接电源时,左槽连接外接电源的正极,发生还原反应 | |
| C. | 负载是镀铜的电镀槽时,H+由左槽向右槽移动 | |
| D. | 充电时若转移电子数为3.01×1023个,左槽溶液中n(H+)的变化量为0.5mol |
14.某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子.在a g HmX中所含质子的物质的量是( )
| A. | a×(A-N+m)/(A+m)mol | B. | a×(A-N)/Amol | C. | a×(A-N)/(A+m)mol | D. | a×(A-N+m)/Amol |
19.下列各项表达中正确的是( )
| A. | Na2O2的电子式为 | |
| B. | 16g甲烷完全燃烧生成的CO2为11.2L(标准状况) | |
| C. | 在氮原子中,质子数为7而中子数不一定为7 | |
| D. | Cl-的结构示意图为 |