题目内容
4.与铬原子同周期且最外层电子数相同的一种金属R的晶胞结构如图甲所示,R的某种氯化物的晶胞结构如图乙所示,则该氯化物的化学式是CuCl,若R与Cl 原子最近的距离为a cm,则该晶体的密度为$\frac{3\sqrt{3}×99.5}{16{N}_{A}{a}^{3}}$g/cm3(阿伏加德罗常数用NA表示)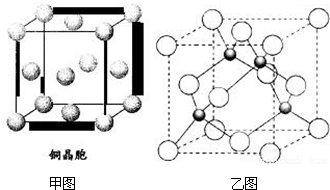
分析 晶胞中Cu位于顶点、面心,Cl原子位于晶胞内部,根据均摊法计算晶胞中Cu原子、Cl原子数目,进而确定化学式;
根据晶胞含有原子数目,计算晶胞质量.Cl原子与周围的4个Cu原子形成正四面体结构,Cl原子位于正四面体的中心,Cu原子位于正四面体的顶点,设正四面体的棱长为x cm,则正四面体的斜高为$\frac{\sqrt{3}}{2}$x cm,底面中心到边的距离为$\frac{\sqrt{3}}{2}$x cm×$\frac{2}{3}$=$\frac{\sqrt{3}}{3}$x cm,根据正四面体的体积及中心原子与得到形成的四面体的体积关系,可知正四面体的高与中心原子到底面距离之比为4:1,即中心原子到顶点与底面距离之比为3:1,则正四面体的高为(a cm+$\frac{a}{3}$cm),再利用勾股定理计算正四面体的棱长,晶胞棱长为$\frac{\sqrt{2}}{2}$×2x cm=$\sqrt{2}$x cm,根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:晶胞中Cu位于顶点、面心,晶胞中Cu原子为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Cl原子位于晶胞内部,晶胞中Cl原子数目为4,故该晶体化学式为CuCl;
晶胞质量为4×$\frac{64+35.5}{{N}_{A}}$g.Cl原子与周围的4个Cu原子形成正四面体结构,Cl原子位于正四面体的中心,Cu原子位于正四面体的顶点,设正四面体的棱长为x cm,则正四面体的斜高为$\frac{\sqrt{3}}{2}$x cm,底面中心到边的距离为$\frac{\sqrt{3}}{2}$x cm×$\frac{2}{3}$=$\frac{\sqrt{3}}{3}$x cm,根据正四面体的体积及中心原子与得到形成的四面体的体积关系,可知正四面体的高与中心原子到底面距离之比为4:1,即中心原子到顶点与底面距离之比为3:1,则正四面体的高为(a cm+$\frac{a}{3}$cm),由勾股定理:(a cm+$\frac{a}{3}$cm)2+($\frac{\sqrt{3}}{3}$x cm)2=($\frac{\sqrt{3}}{2}$x cm)2,整理的x=$\frac{2\sqrt{6}}{3}$a,晶胞棱长为$\sqrt{2}$×$\frac{2\sqrt{6}}{3}$a cm,故晶胞密度为4×$\frac{64+35.5}{{N}_{A}}$g÷($\sqrt{2}$×$\frac{2\sqrt{6}}{3}$a cm)3=$\frac{3\sqrt{3}×99.5}{16{N}_{A}{a}^{3}}$g/cm3,
故答案为:CuCl;$\frac{3\sqrt{3}×99.5}{16{N}_{A}{a}^{3}}$.
点评 本题考查晶胞计算,需要学生具有一定的空间想象与数学计算能力,难度较大.

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案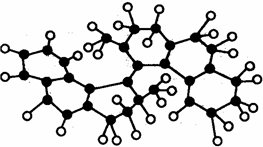 世界上最小的“马达”,只有千万分之一个蚊子那么大,其球棍模型如图(其中小黑球代表碳原子,小白球代表氢原子),它仅有碳氢两种元素组成,将来可用于消除体内垃圾. 该“马达”可能具有的性质是( )
世界上最小的“马达”,只有千万分之一个蚊子那么大,其球棍模型如图(其中小黑球代表碳原子,小白球代表氢原子),它仅有碳氢两种元素组成,将来可用于消除体内垃圾. 该“马达”可能具有的性质是( )| A. | 溶于水 | B. | 可以燃烧 | ||
| C. | 能和溴水发生取代反应 | D. | 能发生消去反应 |
| 化合物 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 |
| 化学式 | A2C | A2C2 | B2A2 | D2C2 | A2E | DF |
(1)元素B的元素符号是:C化合物丙的电子式为
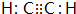 .化合物丁存在的化学键类型是离子键、共价键.
.化合物丁存在的化学键类型是离子键、共价键.(2)化合物甲的沸点比戊高 (填“高”或“低”),B、C、D原子半径从大到小依次为Na>C>O(用元素符号)
(3)向含有0.2mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数为0.2NA (NA代表阿伏加德罗常数)
(4)A单质与C单质在KOH溶液中可以组成燃料电池,则正极附近溶液的pH将变大;放电一段时间KOH的物质的量不变(填“变大”“变小”“不变”)
(5)用电子式表示己的形成过程:
 .
. | A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、Cl- | |
| D. | pH=12的溶液:K+、Na+、CH3COO-、Br- |
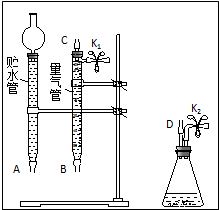 某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.
某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.(1)现有以下仪器和用品:橡胶管、秒表、温度计、amol/L稀硝酸、bmol/L稀硝酸及下图中仪器.
①写出本实验的化学方程式,并标出电子转方向和数目:
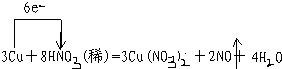 .
.②设计实验方案:在相同稀硝酸浓度、不同温度(或相同温度、不同稀硝酸浓度)下,测定相同时间内产生气体体积(或产生相同体积的气体所需的时间).
③在答卷的图中将A、B、C、D、几处用橡胶管
以正确方式连接起来,以测定反应所产生气体的
体积(三个容器中的液体和水都已画出).
④测定前,为避免NO被氧化为NO2,要用CO2
排出锥形瓶和橡胶管中的空气:装入铜片、松开K2弹簧夹,从K2处的橡胶管向装置中通入CO2,此时K1处应进行的操作是松开K1弹簧夹,接导管通入澄清石灰水至出现白色浑浊为止.
(2)在K2处注入硝酸发生反应.在给定条件下设计实验探究浓度和温度对化学反应速率的影响:温度25℃、50℃;时间t1、t2、t3;收集气体体积V1、V2.请完成下表:
| 实验 编号 | 稀硝酸的浓度/(mol/L) | 稀硝酸的体积/mL | 温度 /℃ | 时间 /min | 收集气体 的体积/mL |
| ① | a | V | 25 | t1 | V1 |
| ② | V | ||||
| ③ | V |
| A. | 由SO2通入Ba(NO3)2溶液产生白色沉淀可知,BaSO3不溶于硝酸 | |
| B. | 电解精炼铜,电解结束后电解质溶液浓度不变 | |
| C. | 海水中Na+、Cl一结晶成NaCl的过程,形成了化学键 | |
| D. | 任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 |

 ;其水溶液长期在空气中放置容易变浑浊,用化学方程式表示该变化2H2S+O2 =2S↓+2H2O;该变化体现出硫元素的非金属性比氧元素弱(填“强”或“弱”).用原子结构解释原因氧和硫同主族,同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱.
;其水溶液长期在空气中放置容易变浑浊,用化学方程式表示该变化2H2S+O2 =2S↓+2H2O;该变化体现出硫元素的非金属性比氧元素弱(填“强”或“弱”).用原子结构解释原因氧和硫同主族,同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱. .该法吸收快,效率高.若在操作中持续通入含SO2的烟气,则最终产物为NaHSO3.室温下,0.1mol/L ①亚硫酸钠 ②亚硫酸氢钠 ③硫化钠 ④硫化氢钠的四种溶液的pH由大到小的顺序是③>①>④>②.(用编号表示)
.该法吸收快,效率高.若在操作中持续通入含SO2的烟气,则最终产物为NaHSO3.室温下,0.1mol/L ①亚硫酸钠 ②亚硫酸氢钠 ③硫化钠 ④硫化氢钠的四种溶液的pH由大到小的顺序是③>①>④>②.(用编号表示) ,
,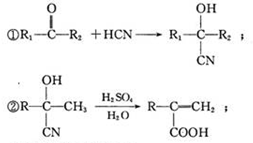
 .
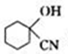
. )结构,萘环上只有1个取代基且水解产物之一能与FeCl3溶液发生显色反应的异构体共有8种(不考虑立体异构),其中核磁共振氢谱有8组峰的是
)结构,萘环上只有1个取代基且水解产物之一能与FeCl3溶液发生显色反应的异构体共有8种(不考虑立体异构),其中核磁共振氢谱有8组峰的是 (写出其中一种的结构简式).
(写出其中一种的结构简式).
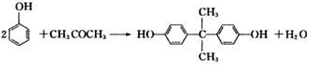
 .
.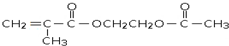 是锂电池正负极之间锂离子迁移的介质.由烃C4H8合成M的合成路线如图:
是锂电池正负极之间锂离子迁移的介质.由烃C4H8合成M的合成路线如图:
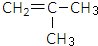 ,试剂II是NaOH水溶液.
,试剂II是NaOH水溶液.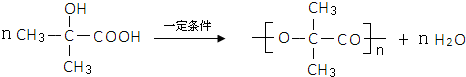 ;
;