题目内容
10.能证明铝的金属性比镁弱的实验事实是( )| A. | Al(OH)3能溶于NaOH溶液,而Mg(OH)2不能 | |
| B. | 铝的原子半径比镁小 | |
| C. | 镁与浓硫酸反应,铝与冷的浓硫酸不反应 | |
| D. | 铝的金属光泽不如镁显著 |
分析 金属性强弱判断方法有:金属之间的置换反应、金属元素氧化物的水化物碱性强弱、金属与水或酸置换出氢元素的难易程度,据此分析解答.
解答 解:金属的金属性越强,金属与酸或水置换出氢气越容易,能置换出较不活泼的金属,金属的氧化物的水化物碱性越强,与金属的导电性强弱、原子半径、氢氧化物的溶解性无关,Al(OH)3能溶于NaOH溶液,而Mg(OH)2则不能,说明氢氧化铝的碱性小于氢氧化镁,则说明Mg的金属性大于Al,
故选A.
点评 本题考查了金属性强弱的判断,明确金属性强弱判断方法是解本题关键,注意:金属的金属性强弱与金属失电子难易程度有关,与失电子多少无关,为易错点.

练习册系列答案
相关题目
20.下列对实验现象或操作的解释不合理的是( )
| 操作及现象 | 解释 | |
| A | 鸡蛋白溶液中分别加入NaCl溶液和HgCl2溶液,均有固体析出 | 蛋白质发生了变性 |
| B | 盛放浓NaOH溶液的试剂瓶用玻璃塞久置后,瓶塞很难打开 | NaOH腐蚀玻璃,生成的硅酸钠将瓶口与瓶塞粘在一起 |
| C | 配制FeCl3溶液时加入适量盐酸酸化 | 抑制Fe3+水解,防止所配制溶液变浑浊 |
| D | 二氧化硫通入溴水,溴水褪色 | 说明二氧化硫具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
18.元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )
| A. | 稀有气体元素 | |
| B. | 左、下方区域的金属元素 | |
| C. | 右、上方区域的非金属元素 | |
| D. | 金属元素和非金属元素分界线附近的元素 |
5.若将14Si的电子排布式写成1s22s22p63s23p${\;}_{x}^{2}$,它违背了( )
| A. | 能量守恒原理 | B. | 泡利原理 | C. | 能量最低原理 | D. | 洪特规则 |
15.A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大.A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;B、A两元素的核电荷数之差等于它们的原子最外层电子数之和;F元素是同周期元素中原子半径最小的主族元素.A、B、C、D、E、F形成的化合物甲、乙、丙、丁、戊、己的组成如下表所示.
回答下列问题
(1)元素B的元素符号是:C化合物丙的电子式为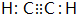 .化合物丁存在的化学键类型是离子键、共价键.
.化合物丁存在的化学键类型是离子键、共价键.
(2)化合物甲的沸点比戊高 (填“高”或“低”),B、C、D原子半径从大到小依次为Na>C>O(用元素符号)
(3)向含有0.2mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数为0.2NA (NA代表阿伏加德罗常数)
(4)A单质与C单质在KOH溶液中可以组成燃料电池,则正极附近溶液的pH将变大;放电一段时间KOH的物质的量不变(填“变大”“变小”“不变”)
(5)用电子式表示己的形成过程: .
.
| 化合物 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 |
| 化学式 | A2C | A2C2 | B2A2 | D2C2 | A2E | DF |
(1)元素B的元素符号是:C化合物丙的电子式为
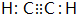 .化合物丁存在的化学键类型是离子键、共价键.
.化合物丁存在的化学键类型是离子键、共价键.(2)化合物甲的沸点比戊高 (填“高”或“低”),B、C、D原子半径从大到小依次为Na>C>O(用元素符号)
(3)向含有0.2mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数为0.2NA (NA代表阿伏加德罗常数)
(4)A单质与C单质在KOH溶液中可以组成燃料电池,则正极附近溶液的pH将变大;放电一段时间KOH的物质的量不变(填“变大”“变小”“不变”)
(5)用电子式表示己的形成过程:
 .
.
19.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、Cl- | |
| D. | pH=12的溶液:K+、Na+、CH3COO-、Br- |
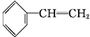 +Br2
+Br2
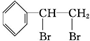 .
. $\stackrel{稀,冷KMnO_{4},溶液/OH-}{→}$
$\stackrel{稀,冷KMnO_{4},溶液/OH-}{→}$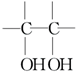 .请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式
.请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式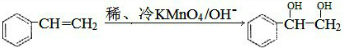 .
. .
. .
.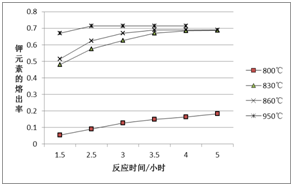 一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s)?KCl(l)+NaAlSi3O8(s)+Q.
一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s)?KCl(l)+NaAlSi3O8(s)+Q.