题目内容
6.下列装置能用于实验室制备HCl气体的是( )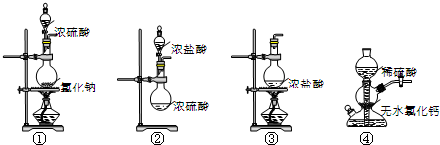
| A. | ①④ | B. | ②③ | C. | ①②③ | D. | ①③④ |
分析 实验室制备氯化氢,可利用盐酸的易挥发性,用浓硫酸与氯化钠、浓盐酸加热制备,注意硫酸钙微溶于水的性质,以此解答该题.
解答 解:①浓硫酸和氯化钠在加热条件下反应可制备氯化氢,利用浓硫酸的酸性和难挥发性,故正确;
②浓硫酸溶于水放热,促进盐酸的挥发,可制备氯化氢,故正确;
③因盐酸易挥发,加热浓盐酸,可生成氯化氢,故正确;
④因氯化钙溶于水,不能用启普发生器制备,故错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握气体的制备方法以及反应原理为解答该题的关键,侧重物质性质及实验技能的考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
16.反应H2+C12=2HCl(△H<0)的机理包含:①C12→2C1(慢)②H2+Cl→HCl+H (快)③C12+H→HCl+Cl(快)等.下列说法不正确的是( )
| A. | 断开lmol H-H键需要的能量大于断开1mol Cl-Cl键需要的能量 | |
| B. | 反应H2+C12=2HCl在光照和加热条件下的△H不同 | |
| C. | 反应①的活化能大于反应②的活化能 | |
| D. | 已知反应②的△H>O,则反应③的△H一定小于0 |
17.对如图两种化合物的结构或性质描述正确的是( )


| A. | 互为同分异构体 | B. | 均能与Na反应且产物相同 | ||
| C. | 均可发生取代反应和加成反应 | D. | 分子中共平面的碳原子数相同 |
14.铜和铜的化合物是重要的化工原料,常用作催化剂、防腐剂和消毒剂等制备合成.已知:CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):(见图1)

(1)配离子[Cu(En)2]2+的中心离子基态外围电子排布式为3d9;乙二胺分子中氮原子轨道的杂化类型为sp3;配离子[Cu(En)2]2+中的配位数为4;
(2)乙二胺和三甲胺[N(CH3)3]均属于胺类,但乙二胺比三甲胺的沸点高的多,原因是乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键;
(3)比较表中有大小(用“大于”或“小于”“等于”填空)
(4)氯和钾与不同价态的铜可形成两种化合物M和N,二都均可用于催化乙炔聚合,二者阴离子均为无限长链结构(见图2),下列分析正确的是BC.
A、图中a位置上Cl原子为sp杂化轨道;
B、M的化学式确认是KCuCl3,则N的化学式为K2CuCl3;
C、配离子[CuCl4]2-和配离子[AlCl4]-空间结构相似;
金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子反应方程式为Cu+H2O2 +4NH3═Cu(NH3)42++2OH-;
(5)金属铁单质的晶体在不同温度下有两种堆积方式(晶胞分别如图3所示).已知体心立方与面心立方的晶胞堆积的空间利用率分别为68%和74%.列算式计算两种晶体的密度之比[ρ(a):ρ(b)]为3$\sqrt{3}$:4$\sqrt{2}$(化简成简单的关系式,不求计算结果,只填写结果不得分).

(1)配离子[Cu(En)2]2+的中心离子基态外围电子排布式为3d9;乙二胺分子中氮原子轨道的杂化类型为sp3;配离子[Cu(En)2]2+中的配位数为4;
(2)乙二胺和三甲胺[N(CH3)3]均属于胺类,但乙二胺比三甲胺的沸点高的多,原因是乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键;
(3)比较表中有大小(用“大于”或“小于”“等于”填空)
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| P>S | H->Li+ | KCl<Si | HClO3<HClO4 |
A、图中a位置上Cl原子为sp杂化轨道;
B、M的化学式确认是KCuCl3,则N的化学式为K2CuCl3;
C、配离子[CuCl4]2-和配离子[AlCl4]-空间结构相似;
金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子反应方程式为Cu+H2O2 +4NH3═Cu(NH3)42++2OH-;
(5)金属铁单质的晶体在不同温度下有两种堆积方式(晶胞分别如图3所示).已知体心立方与面心立方的晶胞堆积的空间利用率分别为68%和74%.列算式计算两种晶体的密度之比[ρ(a):ρ(b)]为3$\sqrt{3}$:4$\sqrt{2}$(化简成简单的关系式,不求计算结果,只填写结果不得分).
15.在中考体育考试中,很多学生在测试结束后感觉小腿酸痛,这是因为在剧烈的高强度运动中,人体内的葡萄糖(C6H12O6)会进行无氧反应,产生乳酸(C3H6O3),下列说法正确的是( )
| A. | 乳酸是一种氧化物 | |
| B. | 1个乳酸分子是由3个碳原子和3个水分子构成 | |
| C. | 葡萄糖与乳酸中所含的原子种类相同 | |
| D. | 葡萄糖不能为人体提供能量 |
 .
. .
.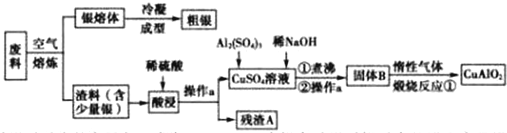
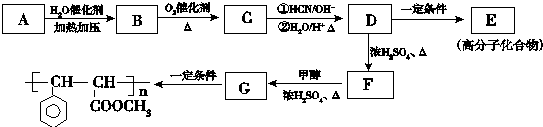
 .
. .
.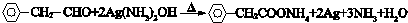 .
. .
.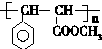 与足量氢氧化钠溶液反应的化学方程式
与足量氢氧化钠溶液反应的化学方程式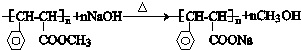 .
.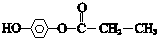 .
.