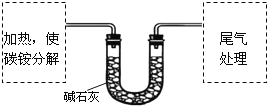
题目内容
【题目】【2016届济南一模】高锰酸钾是常用的消毒剂、除臭剂、水质净化剂以及强氧化剂,下图是在实验室中制备KMnO4晶体的流程:
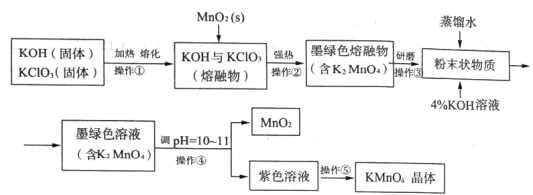
回答下列问题:
(1)操作②目的是获得K2MnO4,同时还产生了KCl和H2O,试写出该步反应的化学方程式: _______________。操作①和②均需在坩埚中进行,根据实验实际应选择_______________(填序号)。
a.瓷坩埚 b.氧化铝坩埚 c.铁坩埚 d.石英坩埚
(2)操作④是使K2MnO4转化为KMnO4和MnO2,该转化过程中发生反应的离子方程式为_______________。若溶液碱性过强,则MnO4-又会转化为MnO42-,该转化过程中发生反应的离子方程式为_______________。因此需要通入某种气体调pH=10-11,在实际操作中一般选择CO2而不是HCl,原因是_______________。
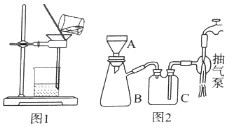
(3)操作⑤过滤时,选择图2所示装置而不用图1所示装置的原因是_______________。
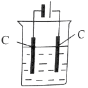
(4)还可采用电解K2MnO4溶液(绿色)的方法制造KMnO4(电解装置如图所示),电解过程中右侧石墨电极的电极反应式为_______________。溶液逐渐由绿色变为紫色。但若电解时间过长,溶液颜色又会转变成绿色,可能的原因是_______________。
【答案】(15分)(1)KClO3+3MnO2+6KOH ![]() 3K2MnO4+KCl+3H2O↑;c;
3K2MnO4+KCl+3H2O↑;c;
(2)3MnO42- + 2H2O = 2MnO4- + MnO2↓+ 4OH-;4MnO4- +4OH- = 4MnO42- + O2↑+ 2H2O;Cl-具有还原性,可将K2MnO4和KMnO4还原;(3)过滤速度快、效果好;
(4)MnO42- -e- = MnO4-;电解较长时间后,阳极产生的MnO4-在阴极被还原,紫色又转变为绿色。(或阴极上氢离子放电生成氢气,同时产生大量的氢氧根离子,溶液碱性增强,紫色又转变为绿色。)
【解析】
试题分析:(1)根据图示,操作②中的反应物有KClO3、MnO2和KOH加热时生成K2MnO4、KCl和H2O,反应的化学方程式为:KClO3+3MnO2+6KOH ![]() 3K2MnO4+KCl+3H2O↑;操作①和②飞反应物中均含有碱性物质,碱能够与氧化铝、二氧化硅及硅酸盐反应,应选择铁坩埚,故答案为:KClO3+3MnO2+6KOH
3K2MnO4+KCl+3H2O↑;操作①和②飞反应物中均含有碱性物质,碱能够与氧化铝、二氧化硅及硅酸盐反应,应选择铁坩埚,故答案为:KClO3+3MnO2+6KOH ![]() 3K2MnO4+KCl+3H2O↑;c;
3K2MnO4+KCl+3H2O↑;c;
(2)操作④中K2MnO4转化为KMnO4和MnO2,反应的离子方程式为:3MnO42- + 2H2O = 2MnO4- + MnO2↓+ 4OH-;若溶液碱性过强,则MnO4-又会转化为MnO42-,反应的离子方程式为:4MnO4- +4OH- = 4MnO42- + O2↑+ 2H2O;通入CO2调pH=10-11,不选用HCl,是因为Cl-具有还原性,可将K2MnO4和KMnO4还原,故答案为:3MnO42- + 2H2O = 2MnO4- + MnO2↓+ 4OH-;4MnO4- +4OH- = 4MnO42- + O2↑+ 2H2O;Cl-具有还原性,可将K2MnO4和KMnO4还原;
(3) 图1为普通过滤装置,图2为抽滤装置,抽滤装置过滤速度快,过滤效果好,且能够过滤颗粒很小是固体和糊状物,故答案为:过滤速度快、效果好;
(4)电解过程中右侧石墨电极连接电源正极,是阳极,发生氧化反应,电极反应式为:若电解时间过长,阳极产生的MnO4-在阴极被还原,紫色又转变为绿色,也可能是阴极上氢离子放电生成氢气,同时产生大量的氢氧根离子,溶液碱性增强,紫色又转变为绿色,故答案为:MnO42- -e- = MnO4-;电解较长时间后,阳极产生的MnO4-在阴极被还原,紫色又转变为绿色。(或阴极上氢离子放电生成氢气,同时产生大量的氢氧根离子,溶液碱性增强,紫色又转变为绿色。)

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案【题目】某铁合金与铁的物理性质的比较如下表所示:
熔点(℃) | 密度(g /cm3) | 硬度(金刚石为10) | 导电性(银为100) | |
某铁合金 | 2500 | 3.00 | 7.4 | 2.3 |
铁 | 1535 | 7.86 | 4.5 | 17 |
又知该铁合金耐腐蚀,强度大。从以上性能看,该铁合金不适合用作( )
A.导线 B.门窗框 C.炉具 D.飞机外壳