【题目】硫酸性质是中学化学学习的重点。请回答下列问题:
(1)中学化学中利用物质与浓硫酸共热可制备SO2气体,写出用浓硫酸还可制备不同类别的气体的名称: (写一种)。
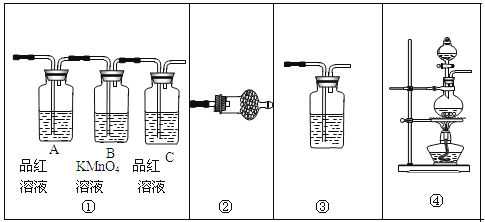
(2)某化学兴趣小组为探究铜与浓硫酸的反应以及SO2的性质,用下图所示装置进行有关实验。
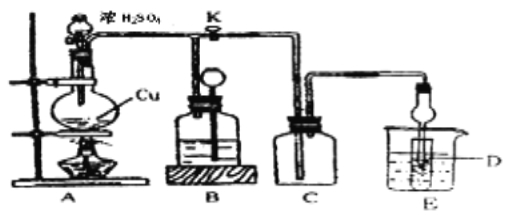
①装置B的作用是贮存多余的气体。B中应放置的液体是_______(填序号)
a.饱和Na2SO3溶液 b.酸性 KMnO4溶液
c.浓溴水 d.饱和NaHSO3溶液
②反应完毕后,烧瓶中还有一定量的余酸,使用足量的下列药品不能用来证明反应结束后的烧瓶中的确有余酸的是____(填序号)。
a.Fe粉 b.BaCl2溶液 c.CuO d.Na2CO3溶液
③实验中某学生向A中反应后溶液中通入一种常见气体单质,使铜片全部溶解且仅生成硫酸铜溶液,该反应的化学方程式是_________。
④为验证二氧化硫的还原性,C中盛有氯水,充分反应后,取C中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“Ⅱ”或“Ⅲ”);C中发生反应的离子方程式为 。D中盛有氢氧化钠溶液,当通入二氧化硫至试管D中溶液显中性时,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
(3)利用FeCl3溶液的氧化性也可以吸收SO2。该反应的离子方程式是 。检验FeCl3是否完全被还原的方法为 。