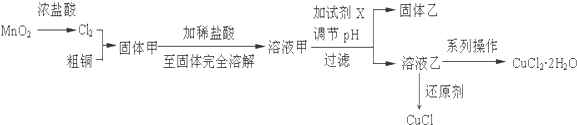
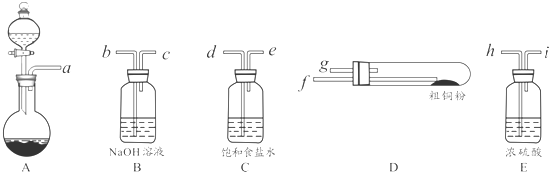
题目内容
10.KMnO4能与热的稀硫酸酸化的Na2C2O4反应,生成Mn2+和CO2,该反应的化学方程式是2KMnO4+5Na2C2O4+8H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O.分析 KMnO4能与热的稀硫酸酸化的Na2C2O4发生氧化还原反应,锰元素由+7价降为+2价,C元素由+3价升高为+4价,依据得失电子守恒,结合原子个数守恒写出方程式.
解答 解:KMnO4能与热的稀硫酸酸化的Na2C2O4发生氧化还原反应,锰元素由+7价降为+2价,C元素由+3价升高为+4价,要想得失电子守恒,则高锰酸钾系数为2,Na2C2O4系数为5,结合原子个数守恒,该反应方程式:2KMnO4+5Na2C2O4+8H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O,
故答案为:2KMnO4+5Na2C2O4+8H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O.
点评 本题考查了化学方程式书写,侧重考查氧化还原反应方程式书写,把握氧化还原反应中得失电子守恒是解题关键,题目难度不大.

练习册系列答案
相关题目
20.下列叙述不正确的是( )
| A. | 可以用NaOH溶液鉴别MgCl2和AlCl3 | |
| B. | 可以用溴水鉴别甲烷和乙烯 | |
| C. | 可以用分液漏斗分离乙酸和乙醇 | |
| D. | 可以用NaOH溶液除去苯中少量的Br2 |
1.我国科学家首次合成了三种新核素,其中一种的名称是铪-185 (18572Hf).关于铪-185的说法正确的是( )
| A. | 铪-185的原子核内有72个电子 | B. | 其中子数比电子数多41 | ||
| C. | 是铪-180的一种新的同素异形体 | D. | 铪-185的原子核内有185个质子 |
18.下列说法正确的是( )
| A. | 化学反应速率可用单位时间内反应物或生成物的物质的量的变化表示 | |
| B. | 硫代硫酸钠与酸反应,一定产生淡黄色的浑浊现象 | |
| C. | 相同物质的量浓度的硫代硫酸钠与稀盐酸反应,其他条件不变,盐酸浓度越大,产生淡黄色浑浊越快 | |
| D. | 相同物质的量浓度的硫代硫酸钠与稀硫酸反应,温度越高,产生淡黄色浑浊越快 |
15.原子序数依次增大的X,Y,Z,W四种短周期元素,X,W原子的最外层电子数与其电子层数相等,X,Z的最外层电子数之和与Y,W的最外层电子数之和相等.甲的化学式为YX3,是一种具有刺激性气味的气体,乙是由X,Y,Z组成的盐.下列说法正确的是( )
| A. | 由X,Y,Z组成的盐的水溶液中阳离子总浓度大于阴离子总浓度 | |
| B. | YX3的水溶液呈弱碱性,能使湿润的蓝色石蕊试纸变红 | |
| C. | X与Z形成的化合物的水溶液可用于雕刻玻璃 | |
| D. | W的氯化物熔点低,易升华,但其水溶液能导电,由此推断它属于弱电解质 |
19.下面关于化学反应的限度的叙述中,正确的是( )
| A. | 化学反应的限度都相同 | |
| B. | 化学反应的限度可以改变 | |
| C. | 可以通过延长化学反应的时间改变化学反应的限度 | |
| D. | 当一个化学反应在一定条件下达到限度时,反应即停止 |
20.回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol(中和热数值为57.3kJ/mol).
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).实验中测得起始温度与终止温度的平均温差为4.0℃则中和热△H=-53.5kJ/mol(取小数点后一位).用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小.(填“偏大”、“偏小”、“无影响”)
(3)X、R是短周期主族元素,X、R在周期表中的相对位置如表所示;X元素最低负化合价的绝对值等于其原子的最外层电子数; 已知由X和R形成的液态化合物XR2的燃烧热是1075kJ/mol,试写出表示其燃烧热的热化学方程式CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol.写出化合物XR2的结构式S=C=S.
(4)白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.已知298K时白磷、红磷完全燃烧的热化学方程式分别为P4(s,白磷)+5O2(g)═P4O10(s)△H1=-2 983.2kJ•mol-1.在298K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)═P4O6(s)△H=-1638kJ•mol-1.在某密闭容器中加入62g白磷和50.4L氧气(标准状况),控制条件使之恰好完全反应.则所得到的P4O10与P4O6的物质的量之比为3:1,反应过程中放出的热量为1323.45 kJ.
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol(中和热数值为57.3kJ/mol).
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).实验中测得起始温度与终止温度的平均温差为4.0℃则中和热△H=-53.5kJ/mol(取小数点后一位).用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小.(填“偏大”、“偏小”、“无影响”)
(3)X、R是短周期主族元素,X、R在周期表中的相对位置如表所示;X元素最低负化合价的绝对值等于其原子的最外层电子数; 已知由X和R形成的液态化合物XR2的燃烧热是1075kJ/mol,试写出表示其燃烧热的热化学方程式CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol.写出化合物XR2的结构式S=C=S.
| X | ||||
| R |