题目内容
5.燃烧8.8g某气态烃,得到26.4g二氧化碳.已知该烃的密度在标准状况下是1.96g/L,求该烃分子式.分析 根据M=ρ×Vm计算出该烃的摩尔质量,然后根据n=$\frac{m}{M}$计算出该气态烃及二氧化碳的物质的量,然后结合质量守恒可确定该烃中含有C原子数,最后根据其摩尔质量确定其分子中含有H原子数,从而得出其分子式.
解答 解:该烃的密度在标准状况下是1.96g/L,则该烃的摩尔质量为:M=ρ×Vm=1.96g/L×22.4L/mol≈44g/mol,
8.8g该气态烃的物质的量为:n=$\frac{8.8g}{44g/mol}$=0.2mol,
26.4g二氧化碳气体的物质的量为:$\frac{26.4g}{44g/mol}$=0.6mol,
则该烃分子中含有C原子数为:N(C)=$\frac{0.6mol}{0.2mol}$=3,
该烃分子中含有H原子数为:N(H)=$\frac{44-12×3}{1}$=8,
所以该烃的分子式为:C3H8,
答:该烃的分子式为C3H8.
点评 本题考查了有机物分子式的计算,题目难度不大,明确标况下密度与摩尔质量之间的关系为解答关键,注意掌握质量守恒定律在确定有机物分子式中的应用方法.

练习册系列答案
相关题目
15.下列关于图所示原电池装置的叙述中,正确的是( )


| A. | 铜片是负极 | |
| B. | 铜片质量逐渐减少 | |
| C. | 电流从锌片经导线流向铜片 | |
| D. | 有6.02×1022个电子经过导线时,锌片质量减少3.25g |
16.下列各项表达中正确的是( )
| A. | 聚丙烯的结构简式: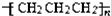 | B. | 乙醇的结构简式:CH3CH2OH | ||
| C. | 四氯化碳的电子式: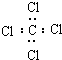 | D. | -CH3(甲基)的电子式为 |
17.下列叙述正确的是( )
| A. | 苯与溴水混合后因发生反应而使溴水褪色 | |
| B. | 在苯中加入酸性KMnO4溶液,振荡后静置,下层液体未褪色 | |
| C. | 1mol苯能与3mol H2发生加成反应,说明在苯环中含有3个双键 | |
| D. | 用冰冷却苯,苯可以凝结成无色的晶体 |
14. Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)
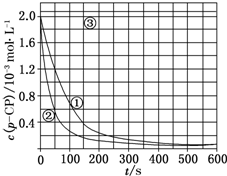
【数据处理】实验测得p-CP的浓度随时间变化的关系如图
(2)请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1;
【解释与结论】
(3)实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:过氧化氢在温度过高时迅速分解;
(4)实验③得出的结论是:pH等于10时,反应不能(填“能”或“不能”)进行;
【思考与交流】
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10(其他合理答案均可).
 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 3 | |||
| ③ | 298 | 10 | 6.0 | 0.30 | |
(2)请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1;
【解释与结论】
(3)实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:过氧化氢在温度过高时迅速分解;
(4)实验③得出的结论是:pH等于10时,反应不能(填“能”或“不能”)进行;
【思考与交流】
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10(其他合理答案均可).

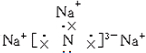 ,该化合物由离子键形成.
,该化合物由离子键形成.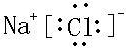 ,
, .
.