题目内容
4.四种常见元素的性质或结构信息如F表所示,请问答下列问题.| 元素 | A | B | R | D |
| 相关信息 | 基态原子核外电子占据3个能级且最高能级上有3个电子 | B的单质是最常见半导体材料 | 位于第四周期ⅠB族 | 是非金属元素,其形成的某种单质是电的良导体,有的分子形状似足球 |
(2)A、B,D均可形成多种氢化物,在最常见的三种氢化物中,分子构型为三角锥的氢化物分子式为NH3,任意写出一种中心原子存在sp2、sp3两种杂化类型的物质的结构简式CH2=CH-CH3,与A的常见单质互为等电子体的上述元素的氧化物是CO.
(3)B、D均可形成氧化物,等物质的量的B、D的最高价氧化物中σ键之比为2:1,已知有下列两种数据:
| 键能(kJ/mol) | 熔点(K) | 沸点(K) | |
| BO2 | B-O:452 | 1923 | 2503 |
| DO2 | D=O:615,D-O:348 | 216 | 195 |
(4)在一定条件下,Cl-与R2+可形成一种无限长链离子
 ,研究表明•
,研究表明•该离子中每个氯原子最外层均达到8电子稳定结构,有些氧与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为${(CuC{l}_{3})}_{n}^{n-}$.
(5)A元素能形成组成为Pt(AH3)2Cl2 的配合物,该配合物存在两种同分异构体:一种为淡黄色(Q),不 具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大.
①Q是非极性(填“极性”或“非极性”)分子,
②P的结构简式为
 ( AH3配体作为一个整体写).
( AH3配体作为一个整体写).
分析 A基态原子核外电子占据3个能级且最高能级上有3个电子,那么A为氮元素;B的单质是最常见半导体材料,故B是硅元素;R位于第四周期ⅠB族,故R为铜元素;是非金属元素,其形成的某种单质是电的良导体,有的分子形状似足球,那么D为碳元素,能导电的是石墨,形状像足球的是足球烯,即C60,据此解答即可;
(1)Cu是29号元素,原子核外电子数为29,根据核外电子排布规律书写铜的基态原子价电子电子排布式,元素的非金属性越强,其第一电离能越大;
(2)N、Si、C的常见氢化物中,氨气属于三角锥形,甲烷构型的为sp3杂化,含有碳碳双键的为sp2杂化,依据等电子体的概念解答即可;
(3)σ键为单键,依据分子式确定比例关系;依据晶体类型回答即可;
(4)依据 该结构分析解答;
该结构分析解答;
(5)若Pt(NH3)2Cl2为四面体结构,此结构中NH3、Cl-之间只存在相邻关系,因此只有一种结构,当Pt(NH3)2Cl2为平面四边形结构时,两个NH3间存在对位与邻位两种关系.因Q溶解度较小,而水为极性分子,故Q是非极性分子,据此解答即可.
解答 解:(1)Cu是29号元素,原子核外电子数为29,铜的基态原子价电子电子排布式3d104s1,元素的非金属性越强,其第一电离能越大,由于非金属性N>C>Si>Cu,故答案为:3d104s1; N>C>Si>Cu;
(2)N、Si、C的常见氢化物中,氨气属于三角锥形,甲烷构型的为sp3杂化,含有碳碳双键的为sp2杂化,最简单的此类有机物是丙烯,氮气分子含有2个原子,价电子数是5×2=10,CO中原子个数是2,价电子数是4+6=10,故答案为:NH3;CH2=CH-CH3;CO;
(3)SiO2中每个硅原子形成4个σ键,是sp2杂化;CO2中碳原子形成2个σ键并且无孤电子对,等物质的量的SiO2、CO2中σ键的数目之比为2:1;因CO2属于分子晶体而SiO2属于原子晶体,前者熔点、沸点由比较微弱的范德华力(与化学键强弱无关)决定的而后者是强大的共价键决定的,故答案为:2:1;CO2是分子晶体,熔点、沸点高低是由比较微弱的范德华力决定的而与化学键强弱无关,SiO2属原子晶体,其熔点、沸点高低是由强大的共价键决定的;
(4)由图知,每个Cu2+单独结合两个Cl-,又与另外一个Cu2+共用两个Cl-,故长链中n(Cu2+):n(Cl-)=1:3,化学式为 ${(CuC{l}_{3})}_{n}^{n-}$,故答案为:${(CuC{l}_{3})}_{n}^{n-}$;
(5)①Pt(YH3)2Z2为PtCl2(NH3)2,根据相似相溶原理,因为淡黄色固体Q,较难溶于极性溶剂水,则Q为非金属性分子,故答案为:非极性分子;
②通过相似相溶原理可知两种固体一种为极性分子,另一种为非极性分子,若PtCl2(NH3)2为四面体结构,只能为极性分子,故只能为平面正方形结构,黄绿色(P)在水中的溶解度较大,则P为极性分子,其结构简式为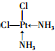 ,故答案为:
,故答案为: .
.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度较大,注意掌握原子结构与元素周期律、元素周期表的关系,(4)为难点.

| A. | 1 mol CH3COOK的质量为98 g•mol-1 | |
| B. | CH3COOK的摩尔质量等于它的相对分子质量 | |
| C. | 一个CH3COOK微粒的质量约为$\frac{98}{6.02×1{0}^{23}}$g | |
| D. | 含有6.02×1023个碳原子的CH3COOK的物质的量为1 mol |
| A. | A>B>C | B. | A<B<C | C. | C>A>B | D. | B>C>A |
 2013年12月2日,我国“嫦娥三号”探测器由长征三号运载火箭发射,首次实现月球软着陆和月面巡视勘察.“玉兔”月球车底盘和车轮由铝合金材料制成.看见玉兔车金灿灿的车身后,小聪同学想到家里新换的水龙头,从说明书上了解到该水龙头是铜质镀铬.好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,请你一同参加.
2013年12月2日,我国“嫦娥三号”探测器由长征三号运载火箭发射,首次实现月球软着陆和月面巡视勘察.“玉兔”月球车底盘和车轮由铝合金材料制成.看见玉兔车金灿灿的车身后,小聪同学想到家里新换的水龙头,从说明书上了解到该水龙头是铜质镀铬.好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,请你一同参加.(1)【知识回访】
金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H)CuHgAg Pt Au.请你在横线上填写对应金属的元素符号.
(2)【作出猜想】
猜想1.Cr>Fe>Cu; 猜想2.Fe>Cu>Cr; 猜想3.你的猜想是Fe>Cr>Cu.
【查阅资料】
①铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜.
②铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液.
(3)【设计与实验】
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸.
| 实验 | 试管1 | 试管2 | 试管3 |
| 实验 操作 |  | 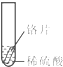 |  |
| 实验 现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变成为蓝色 | 铜表面无气泡,溶液不变色 |
小聪得到的结论是:猜想1正确.
(5)【知识运用】
将铬片投入FeSO4溶液中,反应能(填“能”或“不能”)进行.若能进行,请你写出反应的化学方程式Cr+FeSO4=CrSO4+Fe.
| A. | CO2和NO2 | B. | B3H6N3和C6H6 | C. | CH4和NH4+ | D. | H2O和CH4 |
| 选项 | 化学用语 | 推论 |
| A | ${\;}_{92}^{238}{U}^{3+}$ | 该轴离子核外有89个电子 |
| B | 2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ•mol | 1mol氢气完全燃烧放出热量483.6kJ |
| C | 2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2+Cl2↑ | NaCl氧化性Cl2强 |
| D | FeO+4H++HNO3-=Fe3++NO2↑+2H2O | 氧化亚铁溶于稀硝酸的离子方程式 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 取用AgNO3时,应在实验柜中寻找棕色瓶带有滴管的试剂瓶 | |
| B. | 用稀HNO3清洗做过银镜反应后的试管 | |
| C. | 用NaOH溶液清洗沾有硫磺的试管 | |
| D. | 用稀HCl清洗做过高锰酸钾分解实验的试管 |
