题目内容
13.某学生在实验室进行化学实验,其中他的操作不正确的是( )| A. | 取用AgNO3时,应在实验柜中寻找棕色瓶带有滴管的试剂瓶 | |
| B. | 用稀HNO3清洗做过银镜反应后的试管 | |
| C. | 用NaOH溶液清洗沾有硫磺的试管 | |
| D. | 用稀HCl清洗做过高锰酸钾分解实验的试管 |
分析 A.见光易分解的物质应该放置在棕色瓶中,溶液应该放置在细口瓶中;
B.银和稀硝酸发生氧化还原反应生成可溶性的硝酸银;
C.加热条件下S能和NaOH溶液反应;
D.稀盐酸和二氧化锰在加热条件下不反应.
解答 解:A.见光易分解的物质应该放置在棕色瓶中,溶液应该放置在细口瓶中,硝酸银见光易分解,所以取用AgNO3时,应在实验柜中寻找棕色瓶带有滴管的试剂瓶,故A正确;
B.银和稀硝酸发生氧化还原反应生成可溶性的硝酸银,所以可以用稀硝酸洗涤做过银镜反应的试管,故B正确;
C.加热条件下S能和NaOH溶液反应生成可溶性的钠盐,所以可以用氢氧化钠溶液洗涤沾有S的试管,故C正确;
D.稀盐酸和二氧化锰在加热条件下不反应,可以用浓盐酸洗涤做过高锰酸钾分解实验的试管,故D错误;
故选D.
点评 本题考查化学实验方案评价,侧重考查物质的性质,明确实验原理是解本题关键,知道实验室药品的储存方法,注意S微溶于酒精易溶于二硫化碳,题目难度不大.

练习册系列答案
相关题目
4.四种常见元素的性质或结构信息如F表所示,请问答下列问题.
(1)R的基态原子价层电子排布式为3d104s1,这四种元素的第一电离能由大到小的顺序为N>C>Si>Cu(写元素符号).
(2)A、B,D均可形成多种氢化物,在最常见的三种氢化物中,分子构型为三角锥的氢化物分子式为NH3,任意写出一种中心原子存在sp2、sp3两种杂化类型的物质的结构简式CH2=CH-CH3,与A的常见单质互为等电子体的上述元素的氧化物是CO.
(3)B、D均可形成氧化物,等物质的量的B、D的最高价氧化物中σ键之比为2:1,已知有下列两种数据:
请解释键能大小与两种氧化物熔点、沸点高低差异过大的原因CO2是分子晶体,熔点、沸点高低是由比较微弱的范德华力决定的,而与化学键强弱无关,SiO2属原子晶体,其熔点、沸点高低是由强大的共价键决定的
(4)在一定条件下,Cl-与R2+可形成一种无限长链离子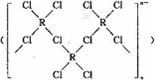 ,研究表明•
,研究表明•
该离子中每个氯原子最外层均达到8电子稳定结构,有些氧与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为${(CuC{l}_{3})}_{n}^{n-}$.
(5)A元素能形成组成为Pt(AH3)2Cl2 的配合物,该配合物存在两种同分异构体:一种为淡黄色(Q),不 具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大.
①Q是非极性(填“极性”或“非极性”)分子,
②P的结构简式为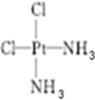 ( AH3配体作为一个整体写).
( AH3配体作为一个整体写).
| 元素 | A | B | R | D |
| 相关信息 | 基态原子核外电子占据3个能级且最高能级上有3个电子 | B的单质是最常见半导体材料 | 位于第四周期ⅠB族 | 是非金属元素,其形成的某种单质是电的良导体,有的分子形状似足球 |
(2)A、B,D均可形成多种氢化物,在最常见的三种氢化物中,分子构型为三角锥的氢化物分子式为NH3,任意写出一种中心原子存在sp2、sp3两种杂化类型的物质的结构简式CH2=CH-CH3,与A的常见单质互为等电子体的上述元素的氧化物是CO.
(3)B、D均可形成氧化物,等物质的量的B、D的最高价氧化物中σ键之比为2:1,已知有下列两种数据:
| 键能(kJ/mol) | 熔点(K) | 沸点(K) | |
| BO2 | B-O:452 | 1923 | 2503 |
| DO2 | D=O:615,D-O:348 | 216 | 195 |
(4)在一定条件下,Cl-与R2+可形成一种无限长链离子
 ,研究表明•
,研究表明•该离子中每个氯原子最外层均达到8电子稳定结构,有些氧与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为${(CuC{l}_{3})}_{n}^{n-}$.
(5)A元素能形成组成为Pt(AH3)2Cl2 的配合物,该配合物存在两种同分异构体:一种为淡黄色(Q),不 具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大.
①Q是非极性(填“极性”或“非极性”)分子,
②P的结构简式为
 ( AH3配体作为一个整体写).
( AH3配体作为一个整体写).
8.下列实验装置能够达到目的是( )
| A. | 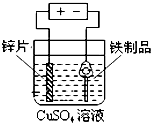 铁制品表面镀锌 | B. | 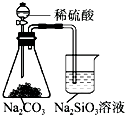 验证碳酸酸性强于硅酸 | ||
| C. | 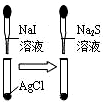 说明溶解性AgCl<AgI<Ag2S | D. |  浸在冷水中的玻璃球颜色较深 |
18.下列化学用语和叙述正确的是( )
| A. | M与N是同素异形体,由M=N;△H=+119kJ/mol可知,N比M稳定 | |
| B. | Na2O2的电子式: | |
| C. | 表示乙炔“燃烧热”对应的热化学方程式:C2H2 (g)+$\frac{5}{2}$O2 (g)═△2CO2 (g)+H2O(g)△H=-1 256kJ/mol | |
| D. | 葡萄糖的实验式:CH2O |
5.下列有机化合物分子中的所有碳原子不可能处于同一平面的是.
| A. | 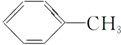 | B. | HC≡C-CH3 | ||
| C. | 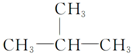 | D. |  |
2.X、Y、Z是三种短周期元素,在周期表中的相对位置如图所示,有关说法正确的是( )
| X | |
| Y | Z |
| A. | X、Y、Z可以都是金属 | |
| B. | 原子半径:Z>Y>X | |
| C. | 最高价氧化物对应的水化物酸性:Z>Y>X | |
| D. | 若X、Y、Z可形成  分子,则其中各原子都满足8电子结构 分子,则其中各原子都满足8电子结构 |
3.以下实验或操作不能达到目的是( )
| A. | 用铜片(必要时可加热)鉴别浓硝酸、稀硝酸、浓硫酸和浓盐酸 | |
| B. | 将氯化铝溶液加热蒸发、烘干可得无水氯化铝固体 | |
| C. | 用酸式滴定管量取8.00mL1mol/L的KMnO4溶液 | |
| D. | 配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,必须重新配制 |
 ,写出一个能证明D、E两元素非金属性强弱的事实或反应方程式:Cl2+H2S=2HCl+S↓.
,写出一个能证明D、E两元素非金属性强弱的事实或反应方程式:Cl2+H2S=2HCl+S↓. (或
(或 ),其中含有的化学键为极性键(或极性键、非极性键)(填“极性键”“非极性键”“离子键”).(若有多种可能,只需答出其中一种物质)
),其中含有的化学键为极性键(或极性键、非极性键)(填“极性键”“非极性键”“离子键”).(若有多种可能,只需答出其中一种物质)