题目内容
13.向30mL1mol•L-1的AlCl3溶液中逐渐加入浓度为4mol•L-1的NaOH溶液,若产生0.78g白色沉淀,则加入的NaOH溶液的体积可能为( )| A. | 3mL | B. | 10mL | C. | 15mL | D. | 27.5mL |
分析 n(AlCl3)=0.03 mol,n[Al(OH)3]=0.01 mol,由沉淀的物质的量小于氯化铝的物质的量可推知此题可能有两个答案:一是氢氧化钠不足,二是氢氧化钠过量,据此分析解答.
解答 解:n(AlCl3)=0.03 mol,n[Al(OH)3]=0.01 mol,由沉淀的物质的量小于氯化铝的物质的量可推知此题可能有两个答案:一是氢氧化钠不足,二是氢氧化钠过量;
由两者反应的离子方程式知Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O知,
当碱的量不足时,只发生反应Al3++3OH-═Al(OH)3↓,根据氢氧化铝和氢氧根离子之间的关系式得,则V(NaOH)=$\frac{\frac{0.78g}{78g/mol}×3}{4mol/L}$=7.5 mL;
当碱过量时,生成氢氧化铝发生的反应为Al3++3OH-═Al(OH)3↓,根据氢氧化铝和氢氧根离子之间的关系式得,则V(NaOH)=$\frac{\frac{0.78g}{78g/mol}×3}{4mol/L}$=7.5 mL;
根据铝离子守恒得n(AlO2-)=0.03mol-0.01mol=0.02mol,发生的反应为Al3++4OH-═AlO2-+2H2O,根据方程式知,生成偏铝酸根离子需要氢氧化钠体积=$\frac{0.02mol×4}{4mol/L}$=20mL,
所以一共需要氢氧化钠体积为7.5mL+20mL=27.5mL,
故选D.
点评 本题考查了物质的量的有关计算,明确氯化铝和氢氧化钠之间的反应是解本题关键,注意要分情况讨论,很多同学往往漏掉氢氧化钠溶液和氢氧化铝的反应而导致错误,为易错题.

练习册系列答案
相关题目
18.下列关于钠原子和钠离子的叙述正确的是( )
| A. | 钠离子比钠原子少了一个质子 | |
| B. | 钠原子有还原性,钠离子有氧化性 | |
| C. | 钠原子和钠离子有相似的化学性质 | |
| D. | 钠原子不稳定,钠离子稳定,两者具有相同的电子层数 |
3.已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质.下面给出13种元素的X的数值:
试结合元素周期律知识完成下列问题:
(1)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlCl3中的化学键类型是共价键.
(2)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系元素X的数值越大,元素的非金属性越强(或元素X的数值越小,元素的金属性越强);简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系原子半径越小,X的数值越大.
(3)请你预测Br与I元素的X数值的大小关系Br大于I.
(4)某化合物分子中含有S-N键,你认为该共享电子对偏向于N原子(填元素符号).
| 元素 | Al | B | Be | C | Cl | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
(1)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlCl3中的化学键类型是共价键.
(2)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系元素X的数值越大,元素的非金属性越强(或元素X的数值越小,元素的金属性越强);简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系原子半径越小,X的数值越大.
(3)请你预测Br与I元素的X数值的大小关系Br大于I.
(4)某化合物分子中含有S-N键,你认为该共享电子对偏向于N原子(填元素符号).
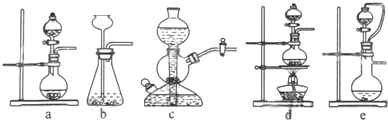

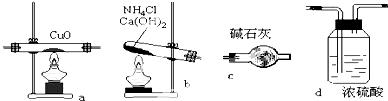 实验室用氨气在加热下还原氧化铜的方法铜的相对原子质量如果选用测定反应物氧化铜和生成物水的质量[m(CO)、m(H2O)]时,如图所示请用下列仪器设计一个简单实验方案.
实验室用氨气在加热下还原氧化铜的方法铜的相对原子质量如果选用测定反应物氧化铜和生成物水的质量[m(CO)、m(H2O)]时,如图所示请用下列仪器设计一个简单实验方案.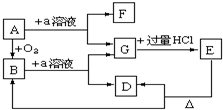 在下列物质的转化关系中,A是一种固体单质,E是一种白色沉淀,F是最轻的气体单质,据此填写下列空白:
在下列物质的转化关系中,A是一种固体单质,E是一种白色沉淀,F是最轻的气体单质,据此填写下列空白: