题目内容
20.A、B、C、D、E是同周期主族元素,A、B的最高价氧化物的水化物呈碱性,且B比A的碱性强,C、D最高价氧化物水化物是酸,且C比D的酸性强,E是这五种元素中半径最大的,则它们的原子序数由小到大的顺序是( )
| A. | E、C、D、B、A | B. | D、B、C、A、E | C. | E、B、A、D、C | D. | A、B、C、D、E |
分析 同周期元素从左到右,随着原子序数的递增,元素的金属性减弱,非金属性增强,原子半径在逐渐减小;A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物显碱性,且碱性B>A,则原子序数B<A;C、D最高价氧化物水化物是酸,且C比D的酸性强,则非金属性C>D,原子序数:C>D,则A、B、C、D的原子序数由小到大的顺序为:B<A<D<C;E是这五种元素中原子半径最大的,同周期元素从左到右,原子半径在逐渐减小,故E的原子序数最小.
解答 解:A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物显碱性,则A、B为金属元素,且碱性B>A,则原子序数B<A;C、D最高价氧化物水化物是酸,且C比D的酸性强,则非金属性C>D,原子序数:C>D;
由同周期元素从左到右,元素的金属性减弱,非金属性增强,则A、B、C、D的原子序数由小到大的顺序为:B<A<D<C,
E是这五种元素中原子半径最大的,同周期元素从左到右,原子半径在逐渐减小,故E的原子序数最小,
所以五种元素的原子序数由小到大的顺序为:E<B<A<D<C,
故选C.
点评 本题考查位置、结构、性质的关系,题目难度不大,明确同周期元素性质的变化规律是解答本题的关键,试题侧重基础知识的考查,有利于培养学生灵活应用基础知识的能力.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
10.下列说法正确的是( )
| A. | 可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝 | |
| B. | 用电解NaCl溶液的方法来冶炼金属钠 | |
| C. | 有些活泼金属如铝可用作热还原法的还原剂 | |
| D. | 金属在地壳中含量很高,回收废旧金属浪费人力物力 |
11.在元素周期表中,某些主族元素与右下方主族元素的有些性质是相似的,被称为“对角线”规则,如:Li和Mg、Be和Al、B和Si.下列说法不正确的是( )
| A. | Li在N2中燃烧生成Li3N | |
| B. | LiOH是极易溶的强碱 | |
| C. | Be(OH)2既能溶于强酸又能溶于强碱溶液 | |
| D. | 硼酸钠溶液显碱性 |
8.下列性质中不属于烷烃具有性质的是( )
| A. | 燃烧产物只有CO2和H2O | B. | 与卤素单质发生取代反应 | ||
| C. | 都溶于水 | D. | 通常不与强酸、强碱、强氧化剂反应 |
15.氧元素有3种核素:${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O.下列有关氧元素的同位素说法中,不正确的是( )
| A. | ${\;}_{8}^{16}$O和${\;}_{8}^{18}$O的质子数相同 | |
| B. | ${\;}_{8}^{16}$O2和${\;}_{8}^{18}$O2互为同素异形体 | |
| C. | ${\;}_{8}^{16}$O和${\;}_{8}^{18}$O中子数相差2 | |
| D. | ${\;}_{8}^{17}$O原子核内中子数与核外电子数之差为1 |
5.若将14Si的电子排布式写成1s22s22p63s23p${\;}_{x}^{2}$,它违背了( )
| A. | 能量守恒原理 | B. | 泡利原理 | C. | 能量最低原理 | D. | 洪特规则 |
12.2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,下列叙述错误的是( )


| A. | a为电池的正极 | B. | 放电时,b极电极反应式:Li-e-=Li+ | ||
| C. | 放电时,a极锂的化合价发生变化 | D. | 放电时,溶液中Li+从b向a迁移 |
9.下列装置不能完成相应实验的是( )
| A. |  装置可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. |  装置可除去CO2中少量的SO2杂质 | |
| C. | 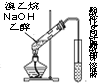 装置可用于检验溴乙烷与NaOH的醇溶液共热产生的乙烯 | |
| D. | 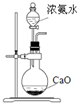 装置可用于实验室制备氨气 |
10.下列有关仪器的使用方法或实验操作正确的是( )
| A. | 用陶瓷坩埚熔化氢氧化钠固体 | |
| B. | 用碱式滴定管准确量取15.00mLKMnO4溶液 | |
| C. |  用如图所示操作排除碱式滴定管中的气泡 | |
| D. | 用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出 |