题目内容
12.2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,下列叙述错误的是( )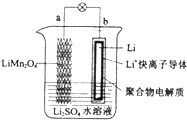
| A. | a为电池的正极 | B. | 放电时,b极电极反应式:Li-e-=Li+ | ||
| C. | 放电时,a极锂的化合价发生变化 | D. | 放电时,溶液中Li+从b向a迁移 |
分析 该原电池中,Li失电子作负极、LiMn2O4作正极,负极反应式为Li-e-=Li+,正极上Li1-xMn2O4得电子发生还原反应,放电时电解质溶液中阳离子向正极移动,据此分析解答.
解答 解:A.该原电池中,Li失电子作负极、LiMn2O4作正极,所以a是正极、b是负极,故A正确;
B.放电时,b为负极,电极反应式:Li-e-=Li+,故B正确;
C.放电时,a为正极,正极上LiMn2O4中Mn元素得电子,所以锂的化合价不变,故C错误;
D.放电时,溶液中Li+从负极b向正极a迁移,故D正确;
故选C.
点评 本题考查化学电源新型电池,正确判断正负极及正负极上发生的反应是解本题关键,知道电解质溶液中阴阳离子移动方向,难点是电极反应式的书写,题目难度中等.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
2.下列说法正确的是( )
| A. | 在Na2S溶液中:c(Na+)=c(HS-)+c(S2-) | |
| B. | 乙烯的燃烧热为akJ•mol-1(a>0),则乙烯燃烧的热化学方程式可表示为C2H4(g)+3O2(g)=2CO2(g)+2H2O(g)△H=-akJ•mol-1 | |
| C. | 钢铁发生吸氧腐蚀的正极反应式为O2+4e-+2H2O=4OH- | |
| D. | 从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
20.A、B、C、D、E是同周期主族元素,A、B的最高价氧化物的水化物呈碱性,且B比A的碱性强,C、D最高价氧化物水化物是酸,且C比D的酸性强,E是这五种元素中半径最大的,则它们的原子序数由小到大的顺序是
( )
( )
| A. | E、C、D、B、A | B. | D、B、C、A、E | C. | E、B、A、D、C | D. | A、B、C、D、E |
7.国际理论与应用化学联合会(IUPAC)在2012年5月30日宣布第116号元素的元素符号是Lv,此前暂用名为Uuh.下列有关叙述中错误的是( )
| A. | Lv位于周期表中第七周期第ⅥA族 | B. | Lv原子的次外层电子数为18 | ||
| C. | Lv为非金属元素 | D. | Lv为放射性元素 |
17.同分异构体数目与C6H14相同的化合物是( )
| A. | C4H8 | B. | C4H9Cl | C. | C4H10O | D. | C4H8O2 |
4.下列物质的制备中,不符合工业生产实际的是( )
| A. | NH3$→_{催化剂}^{O_{2}}$NO$\stackrel{O_{2}}{→}$ NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| B. | 浓缩海水$\stackrel{Cl_{2}}{→}$Br2$\stackrel{SO_{2}}{→}$ HBr$\stackrel{Cl_{2}}{→}$ Br2 | |
| C. | 饱和食盐水$\stackrel{电解}{→}$Cl2$\stackrel{Ca(OH)_{2}}{→}$ 漂白粉 | |
| D. | H2和Cl2混合气体$\stackrel{光照}{→}$HCl气体$\stackrel{水}{→}$ 盐酸 |
1.铋元素可表示为 83Bi,在元素周期表中相对原子质量标示为209.0,下列说法正确的是( )
| A. | Bi元素的质量数是209 | |
| B. | Bi元素最高价氧化物的化学式为Bi2O3 | |
| C. | Bi原子最高价氧化物的水化物酸性比硝酸的要强 | |
| D. | Bi元素位于元素周期表第六周期第ⅤA族 |
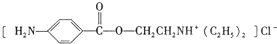 )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:

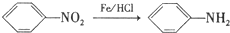

 .
.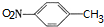 ,C中含氧官能团的名称为硝基、羧基.
,C中含氧官能团的名称为硝基、羧基. +HOCH2CH2N(C2H5)2$\stackrel{一定条件下}{→}$
+HOCH2CH2N(C2H5)2$\stackrel{一定条件下}{→}$ +H2O.
+H2O. (任写一种).
(任写一种). )是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式
)是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式 .
.